
 2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。科目:高中化学 来源:不详 题型:单选题

 N2O4(g)△H<0。
N2O4(g)△H<0。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4 △H<0,如把烧瓶置于100℃的沸水中,则下列几项性质中:①颜色 ②平均分子量 ③质量 ④压强 ⑤密度,其中不会改变的是
N2O4 △H<0,如把烧瓶置于100℃的沸水中,则下列几项性质中:①颜色 ②平均分子量 ③质量 ④压强 ⑤密度,其中不会改变的是| A.①和③ | B.③和⑤ | C.④和⑤ | D.②和④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2(g)+Br2(g) 2HBr(g)ΔH<0 2HBr(g)ΔH<0 |
B.N2(g)+3H2(g) 2NH3(g)ΔH<0 2NH3(g)ΔH<0 |
C.A(s) B(s)+ C(g)ΔH>0 B(s)+ C(g)ΔH>0 |
D.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+H2(g),一段时间后达到平衡。对该平衡状态描述正确的是
CO2(g)+H2(g),一段时间后达到平衡。对该平衡状态描述正确的是| A.正反应速率等于零 | B.正反应速率大于逆反应速率 |
| C.正反应速率等于逆反应速率 | D.正反应速率小于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xP(g)+2Q(g),当反应达到平衡时,生成4 mol Q,并测得P的平衡浓度为0.4 mol·L-1,下列叙述中正确的是
xP(g)+2Q(g),当反应达到平衡时,生成4 mol Q,并测得P的平衡浓度为0.4 mol·L-1,下列叙述中正确的是| A.M的转化率为80% | B.x的值为2 |
| C.N的平衡浓度为0.6 mol·L-1 | D.Q的体积分数为40% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
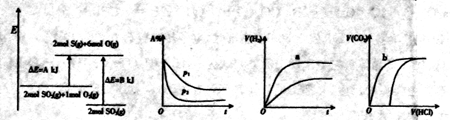
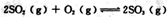 的能量变化,该反应的
的能量变化,该反应的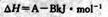
 在不同压强下随时间的变化
在不同压强下随时间的变化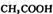 两种溶液中,分别加人足量的锌,产生H2的体积随时间的变化,则a表示
两种溶液中,分别加人足量的锌,产生H2的体积随时间的变化,则a表示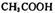 溶液
溶液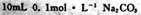 和
和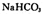 两种溶液中,分别逐滴滴加
两种溶液中,分别逐滴滴加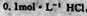 ,产生CO2的体积随盐酸体积的变化,则b表示
,产生CO2的体积随盐酸体积的变化,则b表示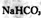 溶液
溶液查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: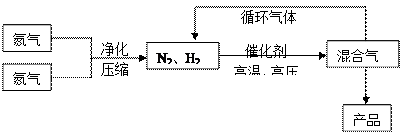
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
| A.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
B.保持温度和活塞位置不变,在甲中 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
D.保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com