
分析 (1)①Ti是22号元素,其3d、4s能级上的电子为其价电子,这两个能级上分别含有2个电子;
②Fe原子核外有1s、2s、2p、3s、3p、3d、4s能级;
(2)①同一周期元素,元素的电负性随着原子序数增大而增大,同一主族元素,元素的电负性随着原子序数增大而减小;
②COCl2分子中所有原子均满足8电子构型,则该分子结构式为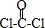 ,共价单键为σ键,共价双键中一个是σ键、一个是π键,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式.
,共价单键为σ键,共价双键中一个是σ键、一个是π键,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式.
解答 解:(1)①Ti是22号元素,其3d、4s能级上的电子为其价电子,这两个能级上分别含有2个电子,则该原子价电子排布式为3d24s2,故答案为:3d24s2;
②Fe原子核外有1s、2s、2p、3s、3p、3d、4s能级,所以共有7个能级,故答案为:7;
(2)①同一周期元素,元素的电负性随着原子序数增大而增大,同一主族元素,元素的电负性随着原子序数增大而减小,所以电负性大小顺序是O>Cl>C,
故答案为:O>Cl>C;
②COCl2分子中所有原子均满足8电子构型,则该分子结构式为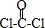 ,共价单键为σ键,共价双键中一个是σ键、一个是π键,所以该分子中σ键和π键个数之比为3:1;
,共价单键为σ键,共价双键中一个是σ键、一个是π键,所以该分子中σ键和π键个数之比为3:1;
该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2,
故答案为:3:1;sp2.
点评 本题考查物质结构和性质,为高频考点,涉及原子核外电子排布、元素周期律、原子杂化方式判断等知识点,明确原子结构、物质结构、原子周期律是解本题关键,熟练掌握原子核外电子排布及其特点,难点是原子杂化方式判断,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
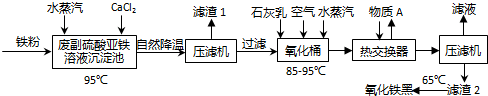
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
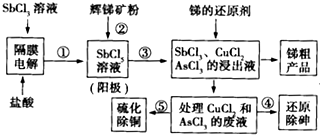 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硫化氢气体通入氯化亚铁溶液:S2-+Fe2+═FeS↓ | |
| C. | 将氯气通入氯化亚铁溶液:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗 0.1molO2则阳极理论上生成 0.2molCl2. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com