
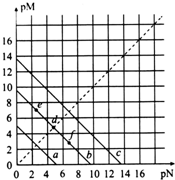
 ��֪��T��ʱ��Ksp��CaSO4��=4.90��10-5��Ksp��CaCO3��=2.8��10-9��Ksp��PbCO3��=8.4��10-14�������εij����ܽ�ƽ��������ͼ��ʾ��pM=-lgc�������ӣ���pN=-lgc�������ӣ�������˵����ȷ���ǣ�������
��֪��T��ʱ��Ksp��CaSO4��=4.90��10-5��Ksp��CaCO3��=2.8��10-9��Ksp��PbCO3��=8.4��10-14�������εij����ܽ�ƽ��������ͼ��ʾ��pM=-lgc�������ӣ���pN=-lgc�������ӣ�������˵����ȷ���ǣ�������| A�� | a�ߴ�������PbCO3 | |
| B�� | T��ʱ����10 mLˮ�м���CaCO3��PbCO3�����߾����ͣ���Һ��c��Ca2+����c��Pb2+��=3��10-5 | |
| C�� | T��ʱ����CaSO4�����м���1 mol/L��Na2CO3��Һ��CaSO4������ת��ΪCaCO3���� | |
| D�� | T��ʱ����CaCO3����Һ�м���NH4Cl���壬��ʹͼ����d����f��ת�� |
���� A������Ũ��Խ����-lgc�����ӣ�ԽС���ݴ�ȷ��a��b��c��Ӧ�����ߣ�
B��CaCO3��PbCO3�ı�����Һ�У�c��Ca2+����c��Pb2+��=$\frac{Ksp��CaC{O}_{3}��}{Ksp��PbC{O}_{3}��}$���ݴ˼��㣻
C��CaSO4�ı�����Һ��c��Ca2+��=7��10-3mol/L��CaSO4�м���1 mol/L��Na2CO3��Һ��Qc��CaCO3��=c��Ca2+����c��CO32-��������Qc��Ksp�Ĺ�ϵ�ش�
D��T��ʱ����CaCO3����Һ�м���NH4Cl���壬�Ȼ��ˮ����ʾ���ԣ�������̼������ӣ�ʹ���ܽ�ƽ�������ƶ���
��� �⣺A������Ũ��Խ����-lgc�����ӣ�ԽС������a��Ӧ����CaSO4��b��CaCO3��c��PbCO3����A����
B��CaCO3��PbCO3�ı�����Һ�У�c��Ca2+����c��Pb2+��=$\frac{2.8��1{0}^{-9}}{8.4��1{0}^{-14}}$=3.3��104����B����
C��CaSO4�ı�����Һ��c��Ca2+��=7��10-3mol/L��CaSO4�м���1 mol/L��Na2CO3��Һ��Qc��CaCO3��=c��Ca2+����c��CO32-��=7��10-3��Ksp��CaCO3��������һ������̼������ɣ�CaSO4������ת��ΪCaCO3��������C��ȷ��
D��T��ʱ����CaCO3����Һ�м���NH4Cl���壬�Ȼ��ˮ����ʾ���ԣ�������̼������ӣ�ʹ���ܽ�ƽ�������ƶ�������c��Ca2+�����ӣ�d������e��ת������D����
��ѡC��
���� ���⿼�����ܵ���ʵ��ܽ�ƽ�⼰�ܶȻ����㣬Ϊ��Ƶ���㣬���ճ����ܽ�ƽ��ͼ���ܶȻ���ʽΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܢ� | B�� | �٢� | C�� | �٢ڢۢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��¯ˮ���е�CaSO4������̼������Һ���ݿ�ת��ΪCaCO3 | |
| B�� | �����£��ں���Ag+��Cl-����Һ�У�Ag+��Cl-Ũ��֮���Ǹ����� | |
| C�� | ������ﵽ����ƽ��ı�ij��������ƽ��������Ӧ�����ƶ�������Һ�ĵ�������һ����ǿ | |
| D�� | ��Ũ��Ϊ0.1 mol/L��HF��Һ��ˮ����ϡ�ͣ���Һ$\frac{c��{F}^{-}��}{c��{H}^{+}��}$ʼ�ձ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����£�����AgCl����ı�����Һ��������ˮϡ�ͣ�c��Ag+����Ksp��AgCl�������ֲ��� | |
| B�� | pH=5��CH3COOH��CH3COONa�Ļ����Һ�У�c��Na+����c��CH3COO-�� | |
| C�� | ��0.2mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������ϣ���Ӧ��Ļ����Һ�У�2c��OH-��+c��CH3COO-��=2c��H+��+c��CH3COOH�� | |
| D�� | ��ˮ������У��ܴٽ�ˮ�ĵ��룬Kw����pH������Һ�ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ﵽƽ��ʱ��c��Pb2+��=c��Fe2+�� | |
| B�� | Ksp��FeS������Ksp��PbS�� | |
| C�� | �÷�Ӧ��ƽ�ⳣ��K=$\frac{{K}_{sp}��FeS��}{{K}_{sp}��PbS��}$ | |
| D�� | ��Һ�м�������Na2S�����c��Fe2+����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
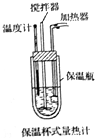 ��ѧ��Ӧ���������ǰ����������ı仯������������ת����
��ѧ��Ӧ���������ǰ����������ı仯������������ת�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
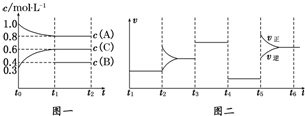
| t1��t2 | t2��t3 | t3��t4 | t4��t5 | t5��t6 |
| K1 | K2 | K3 | K4 | K5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ag C2H4��C3H6�Ļ��������ԭ������Ϊ$\frac{a{N}_{A}}{14}$ | |
| B�� | 0.5mol/L MgCl2��Һ������Cl-������ΪNA | |
| C�� | 10 mL��������Ϊ98%��H2SO4����ˮϡ����100 mL��H2SO4����������Ϊ9.8% | |
| D�� | 300 mL 2 mol/L������Һ����������������0.6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
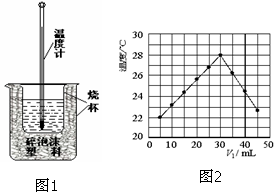 ��ϡ������ϡNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��ϡ������ϡNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com