
 ,
, ;
; ,
, ;
; ,
, ;
; ,
, .
.


科目:高中化学 来源: 题型:
 出该加聚反应的化学方程式(可不写反应条件)
出该加聚反应的化学方程式(可不写反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向逆反应方向移动 |
| B、达新平衡时,c(N2)较原平衡变小 |
| C、达新平衡时,混合气体的密度变小 |
| D、达新平衡时正、逆反应速率均比原平衡变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
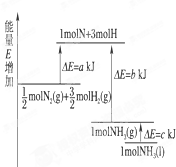
| A、N2(g)+3H2(g)=2NH2(1);△H=2(a-b-c)KJ?mol-1 | ||||
| B、N2(g)+3H2(g)=2NH5(g);△H=2(b-a)KJ?mol-1 | ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgBr见光分解时,主要是光能转化为化学能 |
| B、甲烷燃烧是将全部的化学能转化为热能 |
| C、电池长时间使用会发热,说明部分化学能转变成热能 |
| D、光合作用是将太阳能转化成化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径A>B>C |
| B、元素的非金属性C>B>A |
| C、原子的得电子能力B>A>C |
| D、电子层数A=C>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①④⑤⑥ |
| C、①②③④⑤ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇:
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇:| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com