
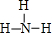 ,故答案为:
,故答案为: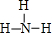 ;
;

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、可能是Al3+,也可能是Mg2+ |
| B、只能是Al3+ |
| C、只能是Mg2+ |
| D、以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
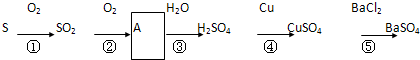
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
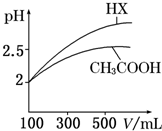 回答下列问题:
回答下列问题:| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
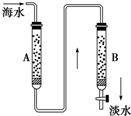 某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.
某地区使用含较多Ca2+、Mg2+的天然水按下列步骤制取纯净水.| ①沉降 |
| ②过滤 |
| ③曝气 |
| ④离子交换 |
| ⑤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 混合物 | 所用试剂 | 方法 |
| A | 乙酸乙酯和乙酸溶液 | 饱和Na2CO3溶液 | 分液 |
| B | 苯中的甲苯 | 溴水 | 分液 |
| C | 溴苯中的溴 | KI溶液 | 分液 |
| D | 乙烯中的SO2 | 溴水 | 洗气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com