
| A��ǰ2s��N2O4��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.01mol��L��1��s��1 |
| B����2sʱ��ϵ��ѹǿΪ��ʼʱ��1.1�� |
| C����ƽ��ʱ��ϵ�ں���N2O40.25mol |
| D��ƽ��ʱ��N2O4��ת����Ϊ40% |
 2NO2��ǰ2sʱ
2NO2��ǰ2sʱ ��2NO2
��2NO2 ��0.005mol��L��1��s��1
��0.005mol��L��1��s��1 2NO2
2NO2 ��1.6�����x��0.3mol��
��1.6�����x��0.3mol�� ��100%��60%��
��100%��60%��

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2����I2
H2����I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g) ��H=akJ/mol���ݻ��̶���2L�ܱ������г���2mol CO(g)��4molH2(g)������Ӧ���ⶨ�ڲ�ͬ�¶ȡ���ͬʱ����CO��ת�������±���
CH3OH(g) ��H=akJ/mol���ݻ��̶���2L�ܱ������г���2mol CO(g)��4molH2(g)������Ӧ���ⶨ�ڲ�ͬ�¶ȡ���ͬʱ����CO��ת�������±���
| A���Ȼ�ѧ����ʽ��a��0 |
| B��T1���£��ڵ�һСʱ����H2��ʾ�Ļ�ѧ��Ӧ����Ϊ0��4mol/(L��h) |
| C��T1���£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ25 |
| D��T2���£���1=��2��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
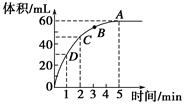
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��v(NH3)��0.01 mol��L��1��s��1 | B��v(O2)��0.001 mol��L��1��s��1 |
| C��v(NO)��0.001 mol��L��1��s��1 | D��v(H2O)��0.045 mol��L��1��s��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��9mol����L��s����1 | B��27mol����L��s����1 |
| C��81mol����L��s����1 | D��243mol����L��s����1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
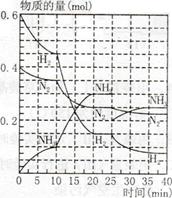
| A����Ӧ��ʼ����һ��ƽ��ʱ��N2��ƽ����Ӧ����Ϊ0.005 mol/(L��min) |
| B�������߿��Կ�������Ӧ���е�10min��20minʱ������ʹ���˴��� |
| C�������߿��Կ�������Ӧ������25minʱ��������0.1mol���� |
| D����25minƽ�������ƶ����ﵽ��ƽ���NH3�����������ԭƽ��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)��D(g)����2 min��B��Ũ�ȼ���0.6 mol/L���Դ˷�Ӧ���ʵı�ʾ��ȷ����(����)
2C(g)��D(g)����2 min��B��Ũ�ȼ���0.6 mol/L���Դ˷�Ӧ���ʵı�ʾ��ȷ����(����)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)������2 s����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ����
2C(g)������2 s����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ����| A���٢� | B���٢� | C���ڢ� | D���ۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com