
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X2H4与H2W都能使溴水褪色 | |
| C. | X的氢化物的沸点一定低于Y的氢化物的沸点 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
分析 X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,故X是碳元素;
Y、W同主族且能形成两种常见的化合物,且原子序数W>Y,则Y为O元素、W为S元素,形成2种常见化合物分别为二氧化硫和三氧化硫;
Y、W质子数之和是Z质子数的2倍,则(8+16)÷2=12,即Z为Mg元素,据此判断即可.
解答 解:X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,故X是碳元素;Y、W同主族且能形成两种常见的化合物,且原子序数W>Y,则Y为O元素、W为S元素,形成2种常见化合物分别为二氧化硫和三氧化硫;Y、W质子数之和是Z质子数的2倍,则(8+16)÷2=12,即Z为Mg元素,
A.电子层数越多,半径越大,同一周期,原子序数越小,半径越大,即原子半径:Mg>S>C>O,故A错误;
B.X2H4与H2W分别为C2H4与H2S,乙烯能够与溴水发生加成反应,硫化氢能够被溴水氧化,故B正确;
C.X、Y分别为C、O,对应氢化物分别为甲烷、水,水分子中存在氢键,则水的沸点大于甲烷,故C正确;
D.元素的金属性越强,其对应最高价氧化物的水化物的碱性越强,由于金属性Na最强,故NaOH碱性最强,不是氢氧化镁,故D错误;
故选BC.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,C为易错点,注意氢键对熔沸点的影响,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
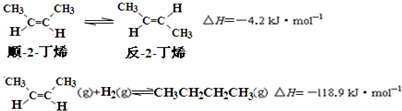
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: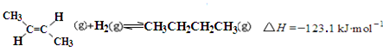 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M<N | C. | M=N | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解; | 溶液呈黄绿色,说明溶液中可能含Fe2+和Fe3+. |
| 步骤2:取少量溶液,滴 加0.01mol/L的KMnO4溶液. | 若紫红色不褪去,则说明催化剂中含铁元素的价态+3价;若紫红色褪去, 则说明催化剂中含有铁元素的价态为+2价 |
| 步骤3:另取少量溶液,滴 加20%的KSCN溶液. | 若溶液变为血红色,则说明催化剂中含铁元素的价态+3价;若溶液无变化,则说明催化剂中含铁元素的价态+2价; |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:5 | C. | 5:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能与溴水反应 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 有机物分子中都存在碳碳单键 | |
| D. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com