
如图23所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
试计算样品中的质量分数,并估算最后溶液的pH。?
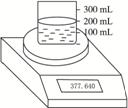
图2-3
w (Na2O2)=91.9% pH=14
由表中数据可知,所取样品的质量为377.640 g-370.000 g=7.640 g,样品投入水中,放出氧气,随着反应的进行,电子天平的读数逐渐减少,至90 s开始读数不变,说明此时过氧化钠已反应完全,此时的质量减少量即为反应生成的氧气的质量377.640 g-376.200 g=1.440 g。设样品中Na2O2的质量为x,生成的NaOH的物质的量为y,则有
2Na2O2+2H2O![]() 4NaOH+O2↑?
4NaOH+O2↑?
156g 4 mol 32g
x?? y? 1.440g
x=![]() =7.020 g?
=7.020 g?
y=![]() =0.180 mol?
=0.180 mol?
w(Na2O2)=![]() ×100%=91.9%
×100%=91.9%
m(Na2O)=7.640 g-7.020 g=0.62 g?
设与水反应生成的NaOH的物质的量为z,则有?
Na2O+H2O![]() 2NaOH?
2NaOH?
62 g 2 mol?
0.62 g z?
z=![]() =0.02 mol?
=0.02 mol?
c(OH-)=c(NaOH)=![]() =1 mol·L-1?
=1 mol·L-1?
c(H+)=10-14mol·L-1pH=14。


科目:高中化学 来源: 题型:阅读理解
| 光 |
| ||
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁是由短周期元素组成的四种物质,它们之间存在如下转化关系:甲+乙→丙+丁
甲、乙、丙、丁是由短周期元素组成的四种物质,它们之间存在如下转化关系:甲+乙→丙+丁| 2 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com