
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
① 写出制取高铁酸钠的化学方程式: ;
② 在制取高铁酸钠的反应中 元素被氧化;
③ 高铁酸钠杀菌作用是利用了其具有的 ,而净水作用的原因是 。
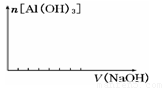
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的溶液中逐滴加入氢氧化钠溶液,将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A1O2-+H2O=Al(OH)3↓+ NH3↑ ,试回答:
① 硫酸铝铵在水溶液中的电离方程式为 ;
② 在向该复盐的溶液中逐滴加入氢氧化钠溶液,请在下图中画出加入氢氧化钠溶液的体积与沉淀物质的量之间的关系。
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
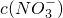 =______(若不存在,此问不必作答).
=______(若不存在,此问不必作答).查看答案和解析>>
科目:高中化学 来源: 题型:
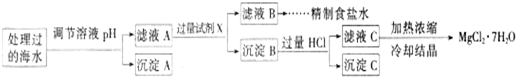
目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点。
(1)在处理水的过程中,Na2FeO4起到杀菌、消毒、净水的作用,请说明应用了Na2FeO4的哪些性质:__________________________________________________________________________
(2) 某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
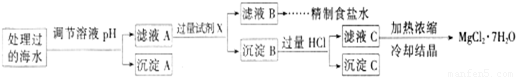
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:

Ksp[Fe(OH)3]=1.0×10-38;Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
① 表格中的a________0.16(填“<”、“>”或“=”)。
② 沉淀A的组成为________(填化学式);在调节溶液pH时,理论上应调节的pH的范围是________。
③ 加入的过量试剂X为____________________(填化学式)。
④ 加入过量HCl的作用为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省本溪一中高三(上)第三次月考化学试卷(解析版) 题型:解答题
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com