
| A. | 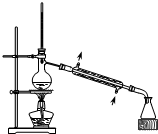 从煤焦油中提取苯 | B. | 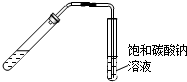 实验室制乙酸乙酯 | ||
| C. | 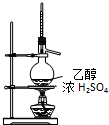 实验室制乙烯 | D. | 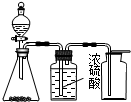 实验室制取、收集乙炔气体 |
分析 A.煤焦油中提取苯,利用互溶液体中混合物的沸点差异分离;
B.需要加热,且导管应在饱和碳酸钠溶液的液面上;
C.制备乙烯测定反应液的温度为170℃;
D.浓硫酸与杂质硫化氢反应生成二氧化硫引入新杂质,且乙炔的密度比空气密度小.
解答 解:A.煤焦油中提取苯,利用互溶液体中混合物的沸点差异分离,选择图中蒸馏装置合理,且温度计的位置、冷却水的方向均合理,故A正确;
B.需要加热,且导管应在饱和碳酸钠溶液的液面上,防止倒吸,故B错误;
C.制备乙烯测定反应液的温度为170℃,则温度计的水银球应在液面下,故C错误;
D.浓硫酸与杂质硫化氢反应生成二氧化硫引入新杂质,且乙炔的密度比空气密度小,则选硫酸铜溶液除杂,利用向下排空气法或排水法收集,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、物质的制备实验等为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及应用,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 第三周期主族元素的最高化合价等于它所在的主族序数 | |
| D. | 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
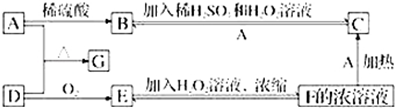
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
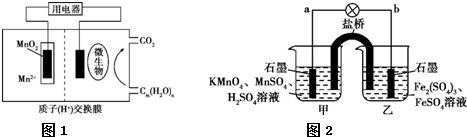
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| H的性质 | 推断H的组成和结构 |
| H完全燃烧的产物只有CO2和H2O | 组成:肯定含碳、氢两种元素,也可能含氧元素 |
| H与乙醇在一定条件下反应均能生成具有果香味的物质,且结构中只存在两种官能团 | 组成:含有O元素 |
| 1.34gH分别与足量的碳酸氢钠溶液和钠反应,生成标准状况下的气体体积分别为0.448L和0.336L | 组成:含有两个-COOH、一个-OH |
| H的碳链无支链 | 结构简式:HOOCCH(OH)CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
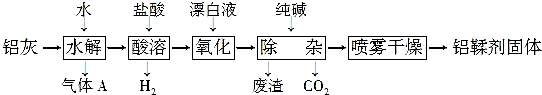
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,若起始时加入1molx和2molY,则平衡时Z的物质的量仍为0.5mol | |
| B. | 其他条件不变,再向容器中加入2 mol X和1 mol Y,平衡正向移动,平衡时X、Y的转化率增大 | |
| C. | 其他条件不变,升高一定温度后,该反应平衡常数K=2.0,则△H>0 | |
| D. | 以x浓度变化表示的反应速率为0.01 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com