
下列拟采用的金属防腐措施,错误的是
A.给金属衣架或电线外面包上一层塑料层
B.给自行车钢圈镀上一层金属铬
C.将铁闸门与铜相连
D.给铁栅栏表面涂上一层油漆
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源:
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol﹣1,其能量变化示意图如下: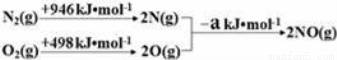
则NO中氮氧键的键能为 kJ•mol﹣1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行 ,并说出理由
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=﹣b kJ•mol﹣1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是 ;
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
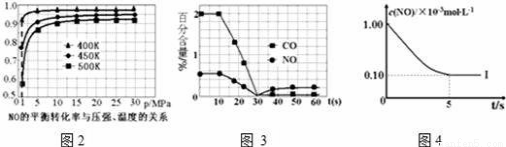
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是 ;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是 ;
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
实验编号 | T(K) | NO初始浓度 (mol•L﹣1) | CO初始浓度 (mol•L﹣1) | 催化剂的比表面积 (m2/g) |
Ⅰ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 82 |
Ⅱ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
Ⅲ | 450 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为 ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:选择题
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
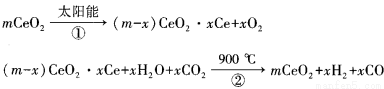
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—= CO32—+2H2O
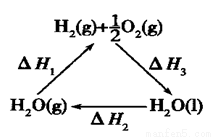
D.上图中△H1=△H2+△H3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上月考二化学试卷(解析版) 题型:选择题
锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环 境无污染。电池总反应式为:V2O5+xLi=LixV2O5。下列说法中,不正确的是
境无污染。电池总反应式为:V2O5+xLi=LixV2O5。下列说法中,不正确的是
A.正极材料为锂,负极材料为V2O5
B.向外供电时,锂离子在凝胶中向正极移动
C.正极的电极反应式为:V2O5+xLi++xe-=LixV2O5
D.负极的电极反应式为:xLi-xe-=xLi+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上月考二化学试卷(解析版) 题型:选择题
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)=C(s)+ H2O (l) ΔH=-131.4 kJ·mol-1
(l) ΔH=-131.4 kJ·mol-1
C.生产水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量
D.生产水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高二上期中文化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.食盐是常用的调味剂和防腐剂
B.淀粉在人体中最终水解为葡萄糖而被吸收
C.多吃含钙丰富的豆腐可预防骨质疏松
D.多吃富含维生素A的鱼肝油可预防坏血病
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高二上期中文化学试卷(解析版) 题型:选择题
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒, 因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高二上期中理化学试卷(解析版) 题型:选择题
橙花醇具有玫瑰及苹果香气,可作为香料。其结构简式如下:
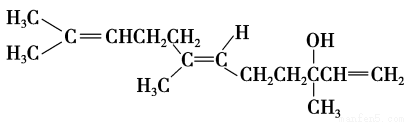
下列关于橙花醇的叙述,错误的是
A.既能发生取代反应,也能发生加成反应
B.橙花醇分子中有1个手性碳原子
C.橙花醇分子中所有碳原子有可能都在同一平面上
D.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三12月月考化学试卷(解析版) 题型:填空题
加热NaHCO3饱和溶液,测得该溶液的pH随温度发生如下变化
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为该溶液的pH升高的原因是HCO3-的水解程度增大,碱性增强。
乙同学认为,该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。
(1)查阅资料,发现NaHCO3的分解温度为150℃,丙断言_________(填“甲”或“乙”)判断是错误的。
(2)关于NaHCO3饱和水溶液的表述正确的是_________
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
(3)某同学用标准盐酸,测定某天然苏打水的NaHCO3的浓度,则测定中应选择的指示剂为 ,若量取20.00mL天然苏打水,则应在 (填仪器名称)中量取
(4)已知0.05mol/LBa(OH)2溶液的pH为11,且该温度下,H2CO3的Ka1=4×10-7,Ka2=4×10-11,则0.1mol/LNa2CO3溶液的pH近似为 (用对数表示)
(5)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(OH)3沉淀,从而除去Fe3+,该反应的离子方程式可表示为 ,该反应的平衡常数为 。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com