
【题目】氨基酸微量元素螯合物在饲料生产应用、解决过量添加无机盐造成环境污染等方面有重要应用。该类螯合物通常以蛋氨酸、赖氨酸、甘氨酸等为配位体,以铜、铁、锌、锰、铬、钴等元素为中心离子。
(1)甘氨酸中共有_____个σ键,所含元素的电负性由大到小的顺序为______,官能团中C原子的杂化方式为_______。
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为______。
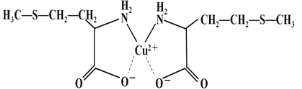
(3)蛋氨酸铜的结构式如下图。该螯合物中含有的化学键类型有_________(填序号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学式为Na3CrO8,其阴离子结构可表示为![]() ,则Cr的化合价为______。
,则Cr的化合价为______。![]() 呈四面体构型,结构为
呈四面体构型,结构为![]() ,
,![]() 由两个
由两个![]() 四面体组成,这两个
四面体组成,这两个![]() 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为![]() 。则由n(n>1)个
。则由n(n>1)个![]() 通过顶角氧原子连结的链式结构的化学式为____。
通过顶角氧原子连结的链式结构的化学式为____。
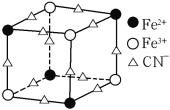
(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是____;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
【答案】9 O>N>C>H sp2 [Ar]3d54s2 abcd +5 ![]() K2[Fe(SCN)5] 4
K2[Fe(SCN)5] 4
【解析】
(1)甘氨酸的结构为: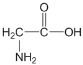 ,1个单键含有1个σ键,一个双键含有1个σ键和1个π键;元素的非金属性越强,其电负性越强;官能团是羧基;
,1个单键含有1个σ键,一个双键含有1个σ键和1个π键;元素的非金属性越强,其电负性越强;官能团是羧基;
(2)基态原子有五个未成对电子的原子是Mn;
(3) Cu2+与N原子形成配位键,相同原子之间形成非极性键、不同原子之间形成极性键,Cu2+与COO-形成离子键;
(4)从阴离子结构可以判断Cr的化合价为+5价。由n(n>1)个![]() 通过共用一个顶角氧原子彼此连接的链式结构,根据连接规律,推断其通式为
通过共用一个顶角氧原子彼此连接的链式结构,根据连接规律,推断其通式为![]() ;
;
(5)Fe3+与SCN-形成配位数为5的配离子为![]() ,根据电荷守恒可知与K+形成的配合物化学式;利用均摊法计算晶胞的
,根据电荷守恒可知与K+形成的配合物化学式;利用均摊法计算晶胞的![]() 结构中Fe3+、Fe2+、CN-数目,结合电荷守恒计算K+数目,进而计算一个晶胞中的K+个数;
结构中Fe3+、Fe2+、CN-数目,结合电荷守恒计算K+数目,进而计算一个晶胞中的K+个数;
(1) 甘氨酸的结构为: ,1个甘氨酸分子中含有σ键的数目为9;元素的非金属性越强,其电负性越强,四种非金属元素的电负性从大到小的顺序是:O>N>C>H;官能团是羧基,羧基上C原子价层电子对个数是3,根据价层电子对互斥理论,杂化类型是sp2,故答案为:9;O>N>C>H;sp2;
,1个甘氨酸分子中含有σ键的数目为9;元素的非金属性越强,其电负性越强,四种非金属元素的电负性从大到小的顺序是:O>N>C>H;官能团是羧基,羧基上C原子价层电子对个数是3,根据价层电子对互斥理论,杂化类型是sp2,故答案为:9;O>N>C>H;sp2;
(2)基态原子有五个未成对电子的原子是Mn,核外电子排布式为:[Ar]3d54s2,故答案为:[Ar]3d54s2;
(3) Cu2+与N原子形成配位键,C-C之间形成非极性键,C-H、C-S之间形成极性键,Cu2+与COO-形成离子键,故答案为:abcd;
(4) 由阴离子结构可知,Cr与O中形成5个价键,共用电子对偏向O,则Cr的化合价为+5价,两个![]() 每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个
每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个![]() 通过角顶氧原子连续的链式,减少(n-1)个氧原子,微粒电荷不变,则由n(n>1)个
通过角顶氧原子连续的链式,减少(n-1)个氧原子,微粒电荷不变,则由n(n>1)个![]() 通过角顶氧原子连续的链式结构的化学式为
通过角顶氧原子连续的链式结构的化学式为![]() ,故答案为:+5;
,故答案为:+5;![]() ;
;
(5) Fe3+与SCN-形成配位数为5的配离子为![]() ,根据电荷守恒可知与K+形成的配合物化学式为K2[Fe(SCN)5];晶胞的
,根据电荷守恒可知与K+形成的配合物化学式为K2[Fe(SCN)5];晶胞的![]() 结构中,Fe3+离子的个数为:
结构中,Fe3+离子的个数为:![]() ,Fe2+离子的个数为:
,Fe2+离子的个数为:![]() ,CN-离子的个数为:
,CN-离子的个数为:![]() ,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),可得N(K+)=
,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),可得N(K+)=![]() ,故一个晶胞中的K+个数=
,故一个晶胞中的K+个数=![]() ,故答案为:K2[Fe(SCN)5];4。
,故答案为:K2[Fe(SCN)5];4。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 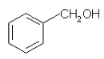 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 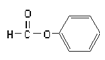 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图________________。
(2)A和D可形成化合物的化学式为______________。
(3)B元素在周期表中的位置为________________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为__________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)______________________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为__________________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为__________,能够用于漂白的固体物质中阴、阳离子个数比为____________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
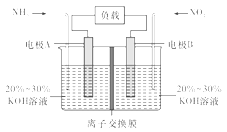
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出阴极反应式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为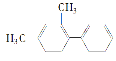 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
A.分子中至少有10个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至多有14个碳原子处于同一平面上
D.该烃不属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是
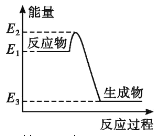
A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
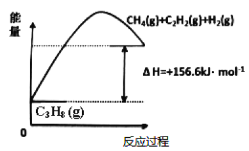
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)2C3H6(g) H>0
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为室温时不同pH下磷酸钠盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、12.66,其中δ表示含磷微粒的物质的量分数。下列说法正确的是
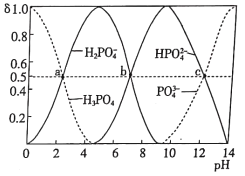
A.选择酚酞作指示剂,用NaOH溶液滴加磷酸溶液的反应为H3PO4+3OH-=PO![]() +3H2O
+3H2O
B.室温下,水电离的c(H+)·c(OH-):a<b<c
C.a、b、c点对应水溶液中c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )之和相等
)之和相等
D.室温下,H3PO4的第三级电离常数的数量级为10-12
查看答案和解析>>
科目:高中化学 来源: 题型:
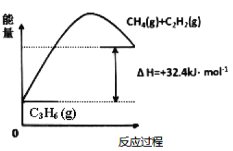
【题目】丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯乙烯、异丙烯等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)![]() C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。

①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___。
②目前在丙烷脱氢制丙烯时常加入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8+C2H4![]() 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某温度下,上述反应中,正反应速率为v正=k正c(C4H8)c(C2H4)、逆反应速率为v逆=k逆c2(C3H6),其中k正、k逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是___。
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使k正和k逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应历程无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___25%。(填“>”、“<”、“=”)
(3)工业上可用丙烯加成法制备1,2—二氯丙烷(CH2ClCHClCH3),主要副产物为3—氯乙烯(CH2=CHCH2Cl),反应原理为
Ⅰ.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
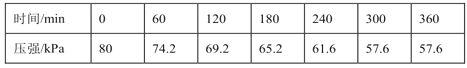
①用单位时间内气体分压的变化来表示反应速率,即v=![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__kPa-1。(Kp为以分压表示的平衡常数,保留小数点后2位。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com