
某有机物X含碳、氢、氧三种元素.欲确定X的分子式,所需下述条件中的最少组合是
①含碳的质量分数 ②含氢的质量分数 ③蒸气的摩尔体积(折合成标准状况下的体积)
④X对H2的相对密度(同温同压) ⑤X的质量 ⑥X的沸点
A.①②③④⑥ B.①③⑥ C.①②④ D.①②
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2016届湖北省枣阳市高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写不正确的是
A.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O
B.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.小苏打溶液中加入少量石灰水:HCO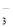 + Ca2+ + OH- = CaCO3↓ + H2O
+ Ca2+ + OH- = CaCO3↓ + H2O
D.用SO2还原含Cr2O72-的酸性废水:Cr2O72-+ 3SO2 + 2H+ = 2Cr3+ + 3SO42-+ H2O
查看答案和解析>>
科目:高中化学 来源:2016届上海市十三校高三上学期第一次联考化学试卷(解析版) 题型:实验题
索氏制碱又称氨碱法,其主要生产流程如右图:
用化学方程式表示沉淀池中发生的反应 ,排出液的主要成分是 。
氨碱法制得的纯碱样品中可能会含有杂质(如NaCl)。现用两个实验方案测定纯碱样品的纯度。
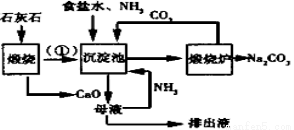
方案1气体法 :称取样品m克装入Y型试管左侧(如右图)
37.Y型试管另一端应装入试剂为 ,量气管中液体应为 。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值 (填“偏大”、“偏小”或“无影响”)。
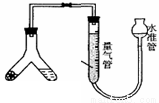
方案2滴定法:
已知: 25℃时0.1 mol/L的NaHCO3溶液的pH约为8.3
0.1 mol/L的Na2CO3 溶液的pH约为11.6
38.指示剂选用酚酞,则该纯碱样品的纯度为 。(请用所给数据的字母符号表示)
氨碱法中钠利用率不高,一些化工专家开始研究有机胺制碱法,其工艺流程如下:
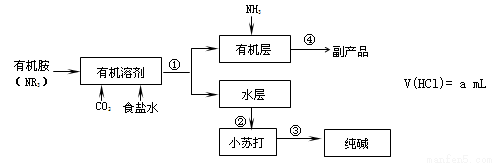
已知: NR3+ HCl →NR3 · HCl,且NR3 · HCl易溶于有机溶剂
NR3 · HCl+NH3→NR3 +NH4Cl
39.有机胺制碱法反应生成小苏打的化学方程式是 , 操作①是 。
40.副产品的成分是 ,本工艺流程中可循环利用的物质是 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第三次月考化学试卷(解析版) 题型:选择题
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是
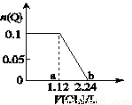
A.Q是I-
B.Q是Br-
C.ab区间的反应:2Fe2++Cl2===2Fe3++2Cl-
D.b点时溶液中只有Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期第三次月考化学试卷(解析版) 题型:选择题
2010年在上海举办的世博会主打环保牌,20辆氢燃料电池公交车、300辆氢燃料电池出租车投入运行,它们以氢气为能源,实现了真正的零污染。氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e-===4OH-
B.该燃料电池的总反应方程式为:2H2+O2===2H2O
C.工作一段时间后,电解液中KOH的物质的量浓度不变
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.2 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上12月月考化学试卷(解析版) 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(已知Al(OH)3具有两性,既可与强酸反应,又可与强碱反应Al(OH)3+NaOH=Na[Al(OH)4]、CO32-与Al3+或Fe3+在水溶液中不能共存,会相互反应产生相应氢氧化物沉淀及CO2气体等)
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_________和_________(填化学式,且相对分子质量最小的写在第一个空);
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质为记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解.则:X为_________;
A.SO3- B.SO42- C.CH3COO- D.SiO32-
(3)向B的水溶液中逐滴加入盐酸且边加边振荡,发现基本没有气泡,原因是____________(用离子方程式表示);
(4)将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为______(保留两位小数)。
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.则物质D一定含有上述离子中的_________(填相应的离子符号).有关反应的离子方程式为_________;
(6)利用上述已经确定的物质,可以检验出D中的阳离子.请简述实验操作步骤、现象及结论_________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×l0–5 | 4.9×l0–10 | K1=4.3×l0–7 K2=5.6×l0–11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)[
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:选择题
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是
N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是
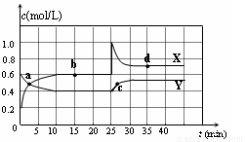
A.图中Y曲线是表示NO2浓度随时间的变化曲线
B.前10 min内v(N2O4)为0.1 mol/( L·min)
C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L
D.25 min时,导致平衡移动的原因是向容器通入适量NO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上12月月考化学试卷(解析版) 题型:选择题
下列灭火剂能用于扑灭金属钠着火的是
A.干冰 B.黄沙
C.干粉(含NaHCO3)灭火剂 D.煤油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com