
 ��Ԫ�غ�±��Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ�����⣮
��Ԫ�غ�±��Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ�����⣮| �� | �� | �� | �� | |
| ��һ�����ܣ�kJ•mol-1�� | 1681 | 1251 | 1140 | 1008 |
���� ��1���崦�ڵ������ڢ�A�壻PCl3��Pԭ�ӹµ��Ӷ���=$\frac{5-1��3}{2}$=1���۲���Ӷ���=3+1=4��
��2�������Ӿ��������Ӱ뾶ԽС�������������Խ�ߣ�������Խ��
��3����һ��������ָԭ��ʧȥһ�������������������һ������ԽС����Խ����ʧȥһ�����ӣ�
��4��s�ܼ���p�ܼ������γɵĹ��ۼ�Ϊs-p�Ҽ���p�ܼ�����֮���γ�˫���������к���p-p�м���
��5��COCl2Ϊƽ���Σ���ṹʽ�� ��Cԭ�ӵ��ӻ������ĿΪ3���ȵ������Ǿ�����ͬ�ļ۵���������ͬԭ����������
��Cԭ�ӵ��ӻ������ĿΪ3���ȵ������Ǿ�����ͬ�ļ۵���������ͬԭ����������
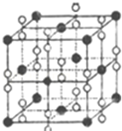
��6�����ݾ�̯��ȷ�������и���ԭ�ӵĸ�������ȷ���仯ѧʽ�����㾧������������ܶ�ȷ�������������������þ����ı߳��������������ĸ���λ�ڶ���������ϵģ����ǵľ���Ϊ�����߳���$\frac{\sqrt{2}}{2}$��
��� �⣺��1���崦�ڵ������ڢ�A�壬�۵����Ų�ʽΪ4s24p5��PCl3��Pԭ�ӹµ��Ӷ���=$\frac{5-1��3}{2}$=1���۲���Ӷ���=3+1=4�����ӿռ乹��Ϊ�����Σ�
�ʴ�Ϊ��4s24p5�������Σ�
��2��CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����������ӵİ뾶С�ڵ����ӣ�����CsCl�ľ����ܴ���CsI�ľ����ܣ�����ӦCsICl2=CsCl+ICl���У��ʴ�Ϊ��A��
��3��I�ĵ�һ������ԽС����������γɽ��ȶ��ĵ��������ӣ��ʴ�Ϊ���⣻
��4��A�� HCl��Ϊ����������s-p�Ҽ���
B��HF��Ϊ����������s-p�Ҽ���
C�� SO2�к���˫��������p-p�м���
D�� SCl2��Ϊ����������p-p�Ҽ���
�ʴ�Ϊ��D��
��5��COCl2Ϊƽ���Σ���ṹʽ�� ��Cԭ�ӵ��ӻ������ĿΪ3���ӻ�����Ϊsp2�ӻ���CO�ĵȵ��������Ϊ��N2�ȣ�
��Cԭ�ӵ��ӻ������ĿΪ3���ӻ�����Ϊsp2�ӻ���CO�ĵȵ��������Ϊ��N2�ȣ�
�ʴ�Ϊ��sp2�ӻ���N2��
��6�������и����ӵĸ���Ϊ8��$\frac{1}{8}$+6��$\frac{1}{2}$=4���������ӵĸ���Ϊ12��$\frac{1}{4}$+1=4�����仯ѧʽΪCaO2����������Ϊ4��$\frac{72}{{N}_{A}}$g���辧���ı߳�Ϊacm����a cm��3����g•cm-3=4��$\frac{72}{{N}_{A}}$g����a=$\root{3}{\frac{4��72}{��{N}_{A}}}$�������������ĸ���λ�ڶ���������ϵģ����ǵľ���Ϊ�����߳���$\frac{\sqrt{2}}{2}$����Ϊ$\frac{\sqrt{2}}{2}��\root{3}{\frac{4��72}{��{N}_{A}}}$cm��
�ʴ�Ϊ��CaO2��$\frac{\sqrt{2}}{2}��\root{3}{\frac{4��72}{��{N}_{A}}}$��
���� �����Ƕ����ʽṹ�����ʵĿ��飬�漰��������Ų��������ܡ�ԭ���ӻ�������ȵ����塢�����ļ����֪ʶ�㣬�е��Ѷȣ�����ʱע�����֪ʶ��������ã�


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
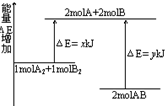
| A�� | �÷�Ӧ�����ȷ�Ӧ | |
| B�� | ����1molA-A����1molB-B�����ɷų�xKJ���� | |
| C�� | ����1molA-B����Ҫ����yKJ���� | |
| D�� | 1molA2��1molB2��ȫ��Ӧ����2molAB���ų���y-x��KJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
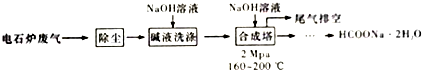
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʾ�Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽ����H�ľ���ֵ��ȷ����C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��g����H=-1367.0kJ•mol-1 | |
| B�� | NH4Al��SO4��2��Һ�м���Ba��OH��2��ҺʹSO42-��ȫ������Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O | |
| C�� | ��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4-+6H++5H2O2=2Mn2++5O2��+8H2O | |
| D�� | �������ữ�ij�ɫ���ظ���أ�K2Cr2O7����Һ���Ҵ�������������Ͳ���ɫ���۸����������ڼ���Ƿ�ƺ��ʻ��2Cr2O72-+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ó涣ҧ��ͿĨ����ˮ��ֹʹ�� | |
| B�� | �����ơ���ʯ�Ż�ʱ��ֱ���ø�ѹˮǹ��ˮ���� | |
| C�� | �����Ʒ����Ҫ�ɷ��뽨������ɰ����ͬ | |
| D�� | ��ͥ�н�����롰84����Һ������ͬʱʹ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
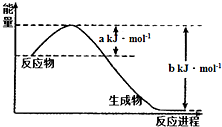 ̼�͵��ǵ����Ϻ����ḻ������Ԫ�أ���������Ļ�ѧ����ѧ������ѧ�о����������������û�ʯȼ�ϣ�����������Ի����ĸ���Ӱ�죮
̼�͵��ǵ����Ϻ����ḻ������Ԫ�أ���������Ļ�ѧ����ѧ������ѧ�о����������������û�ʯȼ�ϣ�����������Ի����ĸ���Ӱ�죮 CO2��g��+NO��g����H=a-bkJ/mol���H=-��b-a��kJ/mol��
CO2��g��+NO��g����H=a-bkJ/mol���H=-��b-a��kJ/mol��| �¶�/�� | n ��C��/mol | n��CO2��/mol |
| T1 | 0.3 | |
| T2 | 0.75 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�� Y�ĵ���������������Һ�����ᷴӦ������������ | |
| B�� | Ԫ�� X�� W�γɵĹ��ۻ������кܶ��� | |
| C�� | Ԫ�� W��X���Ȼ����У���ԭ�Ӿ����� 8 ���ӵ��ȶ��ṹ | |
| D�� | Ԫ�� Z ����Ԫ�� X �γɹ��ۻ����� XZ2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/LCH3COONa��Һ��0.1mol/L HCl��Һ�������ϣ�c��Na+����c��Cl-����c��CH3COO-����c��OH-�� | |
| B�� | 0.1mol/L NH4Cl��Һ��0.1mol/L��ˮ�������ϣ�pH��7����c��NH3��H2O����c��NH4+����c��Cl-����c��OH-�� | |
| C�� | 0.1mol/L Na2CO3��0.1mol/LNaHCO3��Һ�������ϣ�2c��Na+��=3c��HCO3-��+3c��CO32-��+3c��H2CO3�� | |
| D�� | 0.1mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������ϣ�������Һ�У�c��OH-����c��H+��+c��CH3COOH�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com