
����Ŀ���ҹ���������Ԥ����������Ҫ�����������棺�������������NOx������������������ִ�����Ⱦ���Ũ�ȣ�
��1�����뵪�������йص�ȫ��������Դ�������������������ĸ��ţ���
a������ b��ɳ���� c���⻯ѧ���� d������ЧӦ
��������������ø�ѹ�������������������
��2��Ϊ�˽�������β���Դ�������Ⱦ��Ŀǰ����Ч�ķ����Ǹ�������װβ������װ�ã����ܽ�β���е�һ����̼��NO�ڴ��������£�������Ӧת��Ϊ�����壬�䷴Ӧ�Ļ�ѧ����ʽΪ ��
��3����д��ʵ�������ɹ���������ȡ�����Ļ�ѧ����ʽ��
�����ռ�һƿ����İ�����ѡ��ͼ1�е�װ�ã�������˳��Ϊ������װ�á���������������Сд��ĸ��ʾ��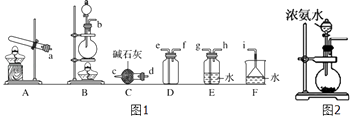
��ʵ����Ҳ����ͼ2��ʾװ����ȡ��������ƿ�ڹ����ѡ����ѡ��ѡ��Ĵ��ţ���
a����ʯ�� b����ʯ�� c���������� d������������
�ܴ��������£�NH3Ҳ����������NOx����Ⱦ���������ֶԻ����������ʣ���д��NH3��NO2��Ӧ�Ļ�ѧ����ʽΪ �� �÷�Ӧ��ÿ����0.5molN2ת�� mol���ӣ�
���𰸡�
��1��ac����Ӿ
��2��2NO+2CO ![]() N2+2CO2
N2+2CO2
��3��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O��d��c��f��e��i��ab��6NO2+8NH3
CaCl2+2NH3��+2H2O��d��c��f��e��i��ab��6NO2+8NH3 ![]() 7N2+12H2O��1.7
7N2+12H2O��1.7
���������⣺��1����a��������������ˮ�������ᣮʹ��ˮpH��5.6����aѡ��
b��ɳ��������������������йأ��뵪�������أ���b��ѡ��
c���⻯ѧ����������β���еĵ����������йأ���cѡ��
d����ɫ��Ⱦ�������йأ���d��ѡ��
ͨ�����Ϸ���֪���뵪�������йصĻ�����Ⱦ�����ꡢ�⻯ѧ������
���Դ��ǣ�ac��
�ڽ�����е�Ӿ�����ʣ�����ӵ�Դ�����£�����Ľ������ܹ����������ƶ����������ø�ѹ������������ڼ���������Ԥ��������Ⱦ�������ý����Ӿ�����ʣ�����������������ø�ѹ������������˵�Ӿ����
���Դ��ǣ���Ӿ����2��NO��CO�ڴ���������ת��Ϊ�����Ͷ�����̼����Ӧ�ķ���ʽΪ��2NO+2CO ![]() N2+2CO2 ��
N2+2CO2 ��
���Դ��ǣ�2NO+2CO ![]() N2+2CO2����3����ʵ�������ɹ���������ȡ����Ϊ�����Ȼ�狀����������Ʒ�Ӧ����Ӧ�ķ���ʽΪ��Ca��OH��2+2NH4Cl
N2+2CO2����3����ʵ�������ɹ���������ȡ����Ϊ�����Ȼ�狀����������Ʒ�Ӧ����Ӧ�ķ���ʽΪ��Ca��OH��2+2NH4Cl ![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
���Դ��ǣ�Ca��OH��2+2NH4Cl ![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��ʵ�����ü��ȹ����Ȼ�狀��������Ƶķ����Ʊ��������Ʊ��������к���ˮ����������Ϊ�������壬Ӧѡ��ʢ�м�ʯ�Ҹ���ܸ������壬������������ˮ���ܶ�С�ڿ����ܶ�����Ӧѡ�������ſ������ռ����壬������������ˮ��β��������ˮ���գ�ע���ֹ�����ķ�����������ȷ������˳��Ϊ������װ�á�d��c��f��e��i��
���Դ��ǣ�d��c��f��e��i��
��a����ʯ���еμӰ�ˮ����ʯ���ܽ���ȣ�ʹ�����ų�������ȷ��
b����ʯ���е��백ˮ���ܽ���ȣ�ʹ�ų�����������ȷ��
C����������������ˮ�����ܷų���������ˮ��Ӱ�죬�������ɰ������ʴ���
D�����������Ͱ�ˮ��Ӧ�����������Σ��������ɰ������ʴ���
���Դ��ǣ�ab��
��NH3����������NO����Ⱦ������2�ֶԻ����������ʣ�Ӧ���ɵ�����ˮ���䷴Ӧ����ʽΪ6NO2+8NH3 ![]() 7N2+12H2O���ɷ���ʽ��֪������7molN2 �� ת��24mol���ӣ���ÿ����0.5molN2ת��1.7mol���ӣ�
7N2+12H2O���ɷ���ʽ��֪������7molN2 �� ת��24mol���ӣ���ÿ����0.5molN2ת��1.7mol���ӣ�
���Դ��ǣ�6NO2+8NH3 ![]() 7N2+12H2O��1.7��
7N2+12H2O��1.7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������Ӧ���Ȼ�ѧ����ʽ(25����101 kPa)��
��C4H10(g)��![]() O2(g)===4CO2(g)��5H2O(l) ��H����2 878 kJ��mol��1
O2(g)===4CO2(g)��5H2O(l) ��H����2 878 kJ��mol��1
��C4H10(g)��![]() O2(g)===4CO2(g)��5H2O(g) ��H����2 658 kJ��mol��1
O2(g)===4CO2(g)��5H2O(g) ��H����2 658 kJ��mol��1
��C4H10(g)��![]() O2(g)===4CO(g)��5H2O(l) ��H����1 746 kJ��mol��1
O2(g)===4CO(g)��5H2O(l) ��H����1 746 kJ��mol��1
��C4H10(g)��![]() O2(g)===4CO(g)��5H2O(g) ��H����1 526 kJ��mol��1
O2(g)===4CO(g)��5H2O(g) ��H����1 526 kJ��mol��1
�ɴ��жϣ��������ȼ������
A. ��H����2 878 kJ��mol��1 B. ��H����2 658 kJ��mol��1
C. ��H����1 746 kJ��mol��1 D. ��H����1 526 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��W��X��Y��Z��ԭ��������������W��X�ļ����Ӿ�����ͬ���Ӳ�ṹ��X��ԭ�Ӱ뾶�Ƕ���������Ԫ��ԭ�������ģ�W��Yͬ�壬Z��X�γɵ����ӻ������ˮ��Һ�����ԣ�����˵����ȷ���ǣ� ��
A.�����Ӱ뾶��W��X��Z
B.W��X�γɵĻ���������ˮ����Һ�ʼ���
C.��̬�⻯������ȶ��ԣ�W��Y
D.����������ˮ��������ԣ�Y��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2+��I����Br������Һ��ͨ���������������Һ���������ӵ����ʵ����仯��ͼ��ʾ����֪b��a=5���߶���ʾһ�ֺ����ᣬ�Ң�͢���ʾ�������к�����ͬ��Ԫ�أ�����˵����ȷ���ǣ� ��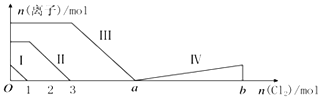
A.�߶��ʾBr���ı仯���
B.�߶���ʾIO3���ı仯���������IO3��������5moL��
C.a=6
D.ԭ��Һ��n��FeI2����n��FeBr2��=3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��YΪ������Ԫ�أ�Xλ��IA�壬X��Y���γɻ�����X2Y������˵����ȷ����
A. X��ԭ�Ӱ뾶һ������Y��ԭ�Ӱ뾶
B. X��Y�ļ����Ӳ����ܾ�����ͬ�ĵ��Ӳ�ṹ
C. ��Ԫ���γɵĻ������У�ԭ�Ӹ����Ȳ�����Ϊ1 ��1
D. X2Y���������ӻ����Ҳ�����ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2��g��+O2��g��2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3�ġ�H=��99kJmol��1 ��
��ش��������⣺
��1��ͼ��A��C�ֱ��ʾ�� �� E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿 �� �÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�������ǽ��ͣ� �� ��������
��2��ͼ�С�H=kJmol��1��
��3��V2O5�Ĵ�ѭ����������Ϊ��V2O5����SO2ʱ����������ԭΪ�ļ۷�������ļ۷��������ٱ�����������д���ô�ѭ�������Ļ�ѧ����ʽ��
��4�������Ӧ���ʦԣ�SO2��Ϊ0.05molL��1min��1 �� ��ԣ�O2��=molL��1min��1���ԣ�SO3��=molL��1min��1��
��5����֪�������ȼ����Ϊ296kJmol��1 �� ������S��s������3molSO3��g���ġ�H��Ҫ�������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС����ʵ����ģ�ҵ�������Ƽ��ԭ����ȡNaHCO3 �� ��ͼ�Ǹ�ѧϰС�����ģ��ʵ��ʱ���õ�����Ҫװ�ã� 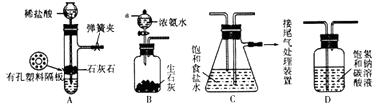
��ش��������⣺
��1��Bװ��������a�������� ��
��2��Cװ���з����������� �� ��Ӧ�Ļ�ѧ����ʽ��
��3������Aװ�������Եķ����ǣ�����������©�����������н����ɼк���©����ע��һ������ˮ��ʹ©���ڵ�ˮ������Թ��ڵ�ˮ�棬ֹͣ��ˮ���� �� ˵��װ�ò�©����
��4��D��������װ��A��װ��C֮������徻��װ�ã�װ��D�������� ��
��5��ʵ��ʱ��NaCl��Һ����ͨ��NH3 �� ��ͨ��CO2��ԭ���� ��
��6�����ʵ�鷽��������NaHCO3��Ʒ���Ƿ����Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ν�Ͻ𣬾��Dz�ͬ�ֽ���(Ҳ����һЩ�ǽ���)���ۻ�״̬���γɵ�һ���ۺ���±�Ϊ���ֽ������ۡ��е㣺
Na | Cu | Al | Fe | |
�۵�/�� | 97.5 | 1083 | 660 | 1535 |
�е�/�� | 883 | 2595 | 2200 | 3000 |
�������������ж����в����γɺϽ����(����)
A. Cu��NaB. Fe��Cu
C. Fe��AlD. Al��Na
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com