
分析 反应物的起始浓度分别为c(M)=1mol•L-1,c(N)=2.4mol•L-1;达到平衡后,M的转化率为60%,则
M(g)+N(g)?P(g)+Q(g)
开始 1 2.4 0 0
转化 0.6 0.6 0.6 0.6
平衡 0.4 1.8 0.6 0.6
(1)K为生成物浓度幂之积与反应物浓度之积的比;
(2)转化率=$\frac{转化的量}{开始的量}$×100%.
解答 解:反应物的起始浓度分别为c(M)=1mol•L-1,c(N)=2.4mol•L-1;达到平衡后,M的转化率为60%,则
M(g)+N(g)?P(g)+Q(g)
开始 1 2.4 0 0
转化 0.6 0.6 0.6 0.6
平衡 0.4 1.8 0.6 0.6
(1)该温度下此反应的平衡常数K=$\frac{0.6×0.6}{0.4×1.8}$=0.5,
答:该温度下此反应的平衡常数为0.5.
(2)此时N的转化率为$\frac{0.6}{2.4}$×100%=25%,
答:此时N的转化率为25%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡常数及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | “碘遇淀粉变蓝色”,“碘”指碘元素 | |
| B. | 为了补碘,要多食用含高碘酸的食物 | |
| C. | 碘水中加入CCl4后,充分混合后静置分层.CCl4在下层,呈现紫红色.如果在太空实验室中混合这两种液体,CCl4就未必在下层 | |
| D. | 通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
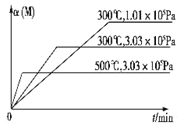 在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )| A. | x=2 | |
| B. | 平衡时,v 正 (B):v 逆 (C)=2:3 | |
| C. | 若保持容器容积不变,充入N,则C的物质的量减小 | |
| D. | 若保持容器容积不变,充入Q,反应①的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某盐溶液进行焰色反应,火焰呈黄色,说明该盐溶液含钠元素,一定不含钾元素 | |
| B. | 用小刀切下一小块金属钠,将剩余的钠再放回原试剂瓶 | |
| C. | 向某溶液中加入BaCl2溶液产生白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- | |
| D. | 向沸水中逐滴滴加1mol•L-1FeCl3溶液,并不断用玻璃棒搅拌,可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①反应:CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH取代反应 | |
| B. | ②反应:CH3CH2OH+O2$→_{△}^{Cu}$ CH3CHO+H2O氧化反应 | |
| C. | ③反应:2 CH3CHO+O2$\stackrel{催化剂}{→}$ 2CH3COOH氧化反应 | |
| D. | ④反应:CH3COOH+C2H5OH $→_{△}^{浓硫酸}$ CH3COOC2H5加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com