
分析 标准状况下,m1g气体G1与m2g气体G2的分子数相同,所以物质的量是相等的,根据公式m=ρV,m=nM=$\frac{N}{{N}_{A}}$M进行计算即可.
解答 解:标准状况下,m1g气体G1与m2g气体G2的分子数相同,所以物质的量是相等的,根据公式m=nM,所以摩尔质量之比等于质量之比,即为m1:m2,
(1)根据公式M=ρVm,同温同压下,气体的Vm是相等的,所以G1与G2的密度比为等于摩尔质量之比,即为m1:m2,故答案为:m1:m2;
(2)根据公式m=$\frac{N}{{N}_{A}}$M,同温同质量的G1和G2的分子数之比等于摩尔质量的倒数之比,即为m2:m1;故答案为:m2:m1;
(3)同温同压下,二者的Vm是相等的.同体积G1和G2的物质的量是相等的,所以质量比为摩尔质量之比,即为m1:m2,故答案为:m1:m2;
(4)两密闭容器,若温度、密度相同(m1>m2),根据公式PV=nRT=$\frac{ρV}{M}$RT,则其压强(p)和摩尔质量的乘积是一个常数,M越大,所以压强越小,二者摩尔质量之比等于质量之比,即为m1:m2,m1>m2,所以压强:G1<G2,故答案为:<.
点评 本题考查学生物质的量的有关公式的应用以及阿伏伽德罗定律的应用知识,注意知识的迁移应用是关键,难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个偏二甲肼分子的质量是60g | |
| B. | 偏二甲肼的摩尔质量是60g | |
| C. | 标况下,1mol偏二甲肼的体积为22.4L | |
| D. | 6g偏二甲肼中电子数目为6NA(NA表示阿伏伽德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是一种非金属单质 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种化合物 | |
| D. | 在受热条件下,HD能还原氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cu2+、Na+、SO42- | |
| B. | 加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| C. | 强酸性溶液中:Fe2+、Al3+、NO3-、Cl- | |
| D. | 酚酞试液显红色的溶液中:Ba2+、Na+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素从化学成分看,它是一种多糖.食物中的纤维素不仅能为人体提供能量,也能促进肠道蠕动、吸附排出有害物质 | |
| B. | 某物质的结构为 ,与其互为同分异构体,且完全水解后产物相同的油脂有3种 ,与其互为同分异构体,且完全水解后产物相同的油脂有3种 | |
| C. | 蛋白质的检验方法有许多种,而与双缩脲试剂作用而产生紫玫瑰色的颜色反应是最常见的方法之一 | |
| D. | 糖类、油脂、蛋白质是人类最主要的能量来源,它们都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 | B. | 碱性 | C. | 氧化性 | D. | 还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
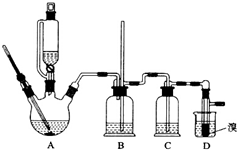 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com