
A.加入5 mL盐酸再进行滴定 B.返滴一滴待测盐酸
C.重新进行滴定 D.以上方法均不适用
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
下列实验操作能达到实验目的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是
Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是查看答案和解析>>
科目:高中化学 来源: 题型:
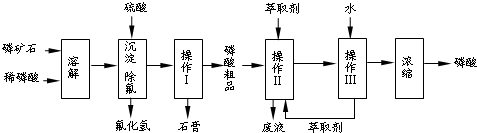
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)该生用托盘天平称量该盐时,在左盘放有一个1 g 的砝码,游码位置如下图所示。

(2)将称好的盐放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂_________________(从酚酞、石蕊中选择)1—2滴,用NaOH溶液滴定至终点,现象是________________________。
(3)该生进行三次实验,所取固体质量均相同,填写下表:
实验编号 | 酸式盐的质量/g | 待测NaOH溶液体积/mL |
1 |
| 18.2 |
2 |
| 17.1 |
3 |
| 16.9 |
(4)滴定中误差较大的是第________次实验,造成这种误差的可能原因是(只填写三种即可):
①_____________________________________________________________;
②_____________________________________________________________;
③_____________________________________________________________。
(5)NaOH溶液的物质的量浓度为___________________(只列出计算式,不必求出结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com