
| A. | 都比较稳定,久置不变浑浊 | B. | 相同的颜色 | ||
| C. | 有丁达尔现象 | D. | 加盐酸先产生沉淀,后沉淀溶解 |
分析 A.胶体具有介稳性,溶液具有稳定性;
B.根据FeCl3溶液与Fe(OH)3胶体的颜色分析解答;
C.只有胶体具有丁达尔效应,溶液不具备;
D.氯化铁与盐酸不反应.
解答 解:A.胶体具有介稳性,放置不会产生沉淀,溶液是稳定的,故A正确;
B.因FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故B错误;
C.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故C错误;
D.Fe(OH)3能与盐酸反应生成氯化铁,氯化铁与盐酸不反应,故D错误.
故选A.
点评 本题考查了胶体的性质以及胶体和溶液的区别,题目难度不大,掌握胶体的性质是解题的关键.


科目:高中化学 来源: 题型:解答题
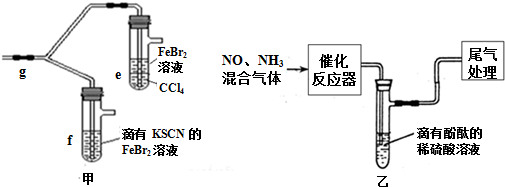
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | OH- | C. | S2- | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
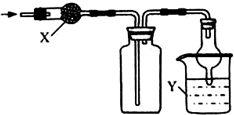
| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 无水氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 无水氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
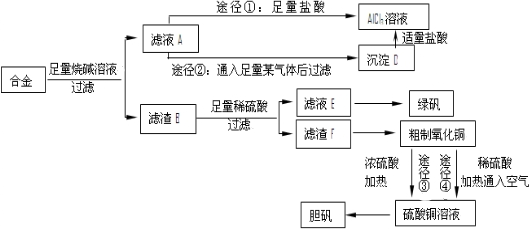
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
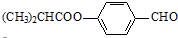 .合成M的一种途径如下
.合成M的一种途径如下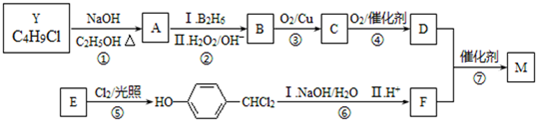
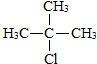 .
.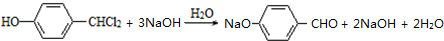 .
. .
.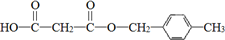 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠溶液的PH 大于7 | |
| B. | 常温时,0.1mol/L乙酸溶液的PH约为3 | |
| C. | 乙酸能和碳酸钙反应放出CO2 | |
| D. | PH=1的醋酸溶液用水稀释1000倍后,pH<4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com