
【题目】下列说法正确的是

A.构成原电池的两个电极必须是活泼性不同的两种金属
B.通过构成原电池,能将反应的化学能全部转化为电能
C.右图原电池中,电池工作时,SO42-移向电池的正极
D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”——质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )

A.工作时“X极”周围溶液的酸性增强
B.氢气在电极上发生还原反应
C.图中标出的“Y极”实际是原电池的负极
D.工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH-反应生成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) ===2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) △H4=____________________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
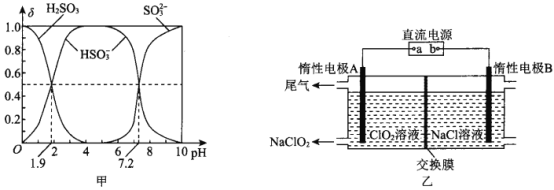
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备 NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)
②阳极的电极反应式为________________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)

(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图(I)所示:
①图(I)中三组实验从反应开始至达到平衡时,v(CO)最大的为___________(填序号)
②与实验a相比,c组改变的实验条件可能是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为____________________B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为______________,此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中久置后铁片会被腐蚀,有关此装置的叙述中正确的是

A.铁片为正极,碳棒为负极
B.铁被腐蚀,碳棒上有氯气放出
C.碳棒附近的溶液可使酚酞变红
D.导线上有电流通过,电流方向是由铁极流向碳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气是一种理想的新能源,与化石燃料相比,氢能源有哪三大优点______、_____、____。
(2)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出甲烷燃烧的热化学方程式_________。
(3)拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则合成氨反应的热化学方程式为_________。
(4)已知:H2 (g) + 1/2O2(g) =H2O (g) △H = -241.8 kJ /mol ;C (s) + O2(g) =CO2(g)△H = -393.5 kJ /mol;现有0.2 mol的炭粉和氢气组成的悬浮气,混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的溴元素主要以Br﹣形式存在于海水中,某学习小组用提取粗食盐后的母液制备溴单质,实验过程如下:
请回答:

(1)下列说法正确的是_____。
A.步骤①试剂X可选氯气,一般在通风橱内进行实验
B.残留液中是否含有溴离子,可通过加CCl4萃取后观察下层溶液颜色来确定
C.溶液A中鼓入热空气是利用溴易挥发的特点分离出溴,也可用水蒸气代替
D.NaOH溶液可用饱和Na2CO3或Na2SO3代替
(2)酸化时用硫酸而不用盐酸的原因可能是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com