
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
 ,每个COCl2分子内含有
,每个COCl2分子内含有

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、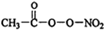 (PAN)等二次污染物.
(PAN)等二次污染物.| m |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验序号 | ||||
| 氢化铝产品粉末质量/g | 2.955 | 5.910 | 11.82 | 23.64 |
| 残留气体的体积/L(标准状况) | 2.24 | 2.24 | 4.48 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图Ⅰ、Ⅱ、Ⅲ所示装置进行有关实验,将A逐滴加入B中.
如图Ⅰ、Ⅱ、Ⅲ所示装置进行有关实验,将A逐滴加入B中.| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com