
【题目】铝是最重要的金属之一,铝及其化合物在生活中有广泛的用途。
(1)纳米铝粉可以作高效催化剂、导电膜层、高档金属颜料等。普通铝在空气中能稳定存在,而纳米铝粉在空气中能自燃,从影响反应速率的角度分析其原因是________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①该反应的化学方程式为_________________。
②MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体。该反应的离子方程式是_____________,该反应中还原剂是___________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
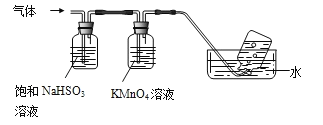
①集气瓶中收集到的气体是_________(填化学式)。
②B中酸性KMnO4溶液褪色(MnO4—还原为Mn2+),发生反应的离子方程式为__________。
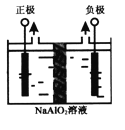
(4)Al(OH)3是重要化工原料。电解法制备高品质Al(OH)3的装置如图(中间用离子交换膜隔开),电解总反应方程式为4NaAlO2+10H2O![]() 4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
【答案】纳米铝粉的表面积大,与氧气的接触更加充分 3MnO2+4Al![]() 3Mn+2A12O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O H2O2 N2 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ 4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑
3Mn+2A12O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O H2O2 N2 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ 4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑
【解析】
(1)纳米铝粉的表面积比普通铝大,与氧气的接触更加充分,所以纳米铝粉在空气中能自燃,故答案为:纳米铝粉的表面积大,与氧气的接触更加充分;
(2)①高温时,铝与二氧化锰发生铝热反应生成锰和氧化铝,反应的方程式为3MnO2+4Al![]() 3Mn+2A12O3,故答案为:3MnO2+4Al
3Mn+2A12O3,故答案为:3MnO2+4Al![]() 3Mn+2A12O3;
3Mn+2A12O3;
②由题意,MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体,说明Mn元素化合价降低被还原,MnO2做氧化剂被还原为Mn2+,氧元素化合价升高被氧化,H2O2做还原剂被氧化生成氧气,反应的化学方程式为MnO2+H2O2+2H+=Mn2++O2↑+2H2O,故答案为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O;H2O2;
(3)①由装置图可知,NH4Al(SO4)2·12H2O煅烧分解生成的气体中,NH3和SO3被饱和亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2,故答案为:N2;
②SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应生成SO42-和Mn2+离子,反应的方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(4)由电解总方程式可知,电解偏铝酸钠溶液制取氢氧化铝时,阳极上水电离出的氢氧根放电生成氧气,破坏水的电离平衡生成氢离子,氢离子与偏铝酸根及水生成氢氧化铝沉淀,电极反应式为4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,故答案为:4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑。


科目:高中化学 来源: 题型:
【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:
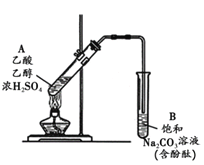
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A. ①中加热利于加快酯化反应速率,故温度越高越好
B. ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C. ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D. 取②中上层油状液体测其,共有3组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国化学家R. F. Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
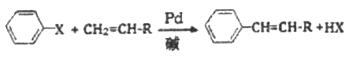 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下:

回答下列问题:
(1)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是____________。D在一定条件下反应生成高分子化合物G,G的结构简式是____________。
(2)在A→B的反应中,检验A是否反应完全的试剂是____________。
(3)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
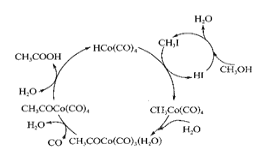
【题目】钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。

(2)下图表示的总反应的化学方程式为______________________。
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有![]() 键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
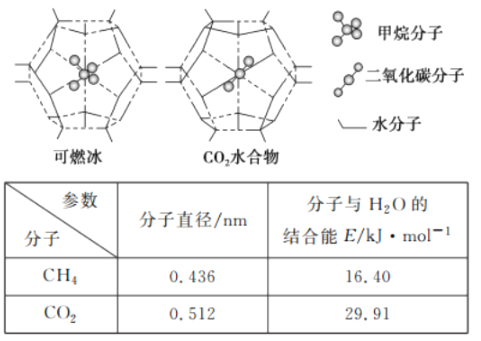
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层的电子数之和。
(1)C2D电子式为__________,D原子的质子数和中子数相等,D的原子组成符号为______。
(2)用电子式表示A、B两元素形成AB2的过程_______________________________。
(3)E和A的最高价氧化物反应的化学方程式_________________________________。
(4)足量的AB2与C的最高价氧化物对应水化物反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】114号元素Fl(中文名“![]() ”)是主族元素,其原子核外最外层电子数是4。下列说法错误的是
”)是主族元素,其原子核外最外层电子数是4。下列说法错误的是
A. Fl的原子核外有114个电子B. Fl是第七周期第IVA族元素
C. Fl单质可能是半导体材料D. Fl的原子半径大于同主族其他元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com