
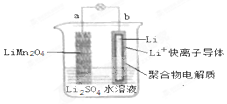
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
分析 放电时,Li易失电子作负极,负极反应式为xLi-xe-═x Li+,正极反应式为xLi++Li1-xMn2O4+xe-═LiMn2O4,得失电子相同时将正负极电极反应式相加即可得到电池反应式,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动.
解答 解:A.根据图知,放电时,b电极上Li失电子生成 Li+,所以b是负极,则a是正极,故A正确;
B.放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4,所以电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi,故B正确;
C.放电时,a极上Li元素化合价都是+1价,化合价不变,故C错误;
D.a是正极、b是负极,放电时电解质溶液中阳离子向正极移动,所以溶液中的Li+从b向a迁移,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意电解质溶液中阴阳离子移动方向,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
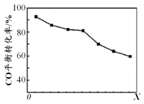 密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:| A. | 由H2和CO直接制备二甲醚的反应为放热反应 | |
| B. | 条件X为压强 | |
| C. | X增大,二甲醚的产率一定增大 | |
| D. | X增大,该反应的平衡常数一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 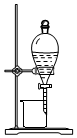 如图所示装置可从碘的CCl4溶液中分离出碘 | |
| B. | 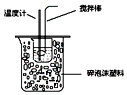 如图所示装置可用于在实验室测定中和反应的反应热 | |
| C. | 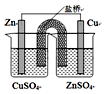 如图所示装置能构成锌铜原电池 | |
| D. | 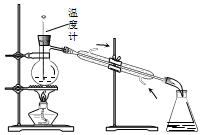 如图所示装置可用于实验室中分馏石油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| B. | 乙醇分子的比例模型: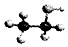 | |
| C. | CF2Cl2有两种同分异构体 | |
| D. | HOCH2COOH缩聚物的结构简式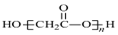 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7克氨气中含有0.1NA个NH3分子 | |
| B. | 标准状况下,2.24 L Cl2溶于水所得溶液中含有Cl_0.1NA | |
| C. | 标准状况下,2.24 L H2O中含有0.1 NA个氧原子 | |
| D. | 0.1mol铁在足量氯气中燃烧,电子转移0.2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
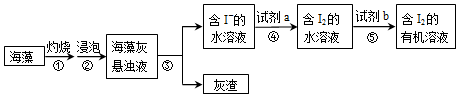
| A. | 试剂a可选用酸化的双氧水 | |
| B. | 试剂b可选用酒精 | |
| C. | 步骤③的操作是过滤 | |
| D. | 步骤①需用坩埚,步骤⑤需用分液漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
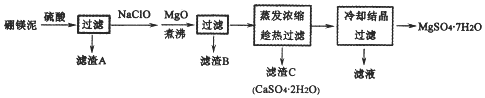
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com