金属单质及其化合物与工农业生产、日常生活有密切的联系.请回答下列问题:
(1)已知下列热化学方程式:
Fe
2O
3(s)+3CO(g)═2Fe(s)+3CO
2(g)△H
1=-25kJ?mol
-13Fe
2O
3(s)+CO(g)═2Fe
3O
4(s)+CO
2(g)△H
2=-47kJ?mol
-1Fe
3O
4(s)+CO(g)═3FeO(s)+CO
2(g)△H
3=+19kJ?mol
-1写出FeO(s)被CO(g)还原生成Fe(s)和CO
2(g)的热化学方程式
.
(2)从矿物学资料查得一定条件下自然界存在如下反应:14CuSO
4+5FeS
2+12H
2O═7Cu
2S+5FeSO
4+12H
2SO
4.则5mol FeS
2发生反应,转移电子的物质的量为
.
(3)一定条件下,用Fe
2O
3、NiO或Cr
2O
3作催化剂对燃煤烟气回收硫.反应为:
2CO(g)+SO
2(g)
2CO
2(g)+S(l)△H=-270kJ?mol
-1其他条件相同、催化剂不同时,SO
2的转化率随反应温度的变化如图1,Fe
2O
3和NiO作催化剂均能使SO
2的转化率达到最高,不考虑催化剂价格因素,选择Fe
2O
3的主要优点是:
.
某科研小组用Fe
2O
3作催化剂,在380℃时,分别研究了[n(CO):n(SO
2)]分别为1:1、3:1时SO
2转化率的变化情况(图2).则图2中表示n(CO):n(SO
2)=3:1的变化曲线为
.
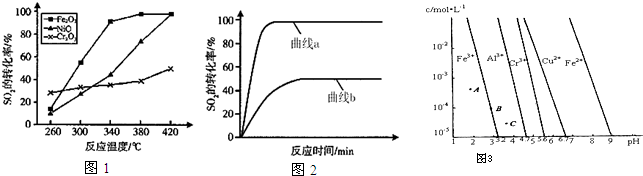
(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图3是某些金属氢氧化物在不同浓度和pH时的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10
-5mol?L
-1时,认为该离子沉淀完全.
①相同条件下,Fe(OH)
3、Al(OH)
3、Cr(OH)
3三种物质的溶度积常数最大的是
,图3中A、B、C三点中表示Fe(OH)
3的沉淀速率大于溶解速率的是
.
②由图3可得Fe(OH)
2的溶度积的值为
.
(5)LiFePO
4电池具有稳定性高、安全、环保等优点,可用于电动汽车.电池反应为:FePO
4+Li
LiFePO
4,电池的正极材料是LiFePO
4,负极材料是石墨,含Li
+导电固体为电解质.放电时电池正极反应为
.



 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案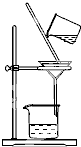 如图所示是粗盐提纯实验操作步骤,其名称为
如图所示是粗盐提纯实验操作步骤,其名称为
