
| A、Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 |
| B、Cu为正极,Zn为负极,稀H2SO4作电解质溶液 |
| C、Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 |
| D、Fe为正极,Zn为负极,CuCl2溶液作电解质溶液 |


科目:高中化学 来源: 题型:
| A、pH=4 |
| B、[H+]=1×10-3 mol?L-1 |
| C、[OH-]=1×10-11 mol?L-1 |
| D、[H+]?[OH-]=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲区呈现红色 |
| B、乙区产生Zn2+ |
| C、丙区发生的电极反应式:Cu-2e-=Cu2+ |
| D、丁区呈现蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
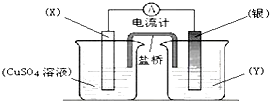
| A、电极X的材料是Cu |
| B、银电极为正极 |
| C、盐桥里Cl-移向电源的负极 |
| D、外电路中每通过0.2mol电子,银电极的质量理论上增加10.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、常温常压下,14g氮气中含有 NA个原子 |
| C、标准状况下,22.4L水中含有的原子数为3NA |
| D、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
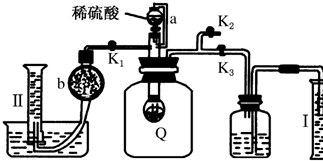 为测定保存在干燥环境中已部分变质的过氧化钠样品(只有一种杂质)的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中.
为测定保存在干燥环境中已部分变质的过氧化钠样品(只有一种杂质)的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com