
| A. | 0.500 mol | B. | 1.00 mol | C. | 0.125mol | D. | 0.25 mol |
分析 根据n=$\frac{N}{{N}_{A}}$计算出氧原子的物质的量,然后结合硫酸的分子式确定H2SO4的物质的量,据此进行解答.
解答 解:根据N=nNA可知,含有3.01×1023个氧原子的物质的量为:n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$mol=0.500mol,结合硫酸的分子式可知,含有0.50molO的硫酸的物质的量为:0.50mol×$\frac{1}{4}$=0.125mol,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数直接的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
 现在,德国的许多餐馆自身就具备油脂分离技术,将”地沟油”分离出来的废油将被制成生物柴油.已知生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换反应生成新酯和新醇得到,酯交换过程可以表示为:
现在,德国的许多餐馆自身就具备油脂分离技术,将”地沟油”分离出来的废油将被制成生物柴油.已知生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换反应生成新酯和新醇得到,酯交换过程可以表示为: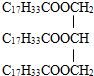 .经上述实验后得到油酸甲酯15.40g,则该实验中生物柴油(全以油酸甲酯计量)的产率为57.8%%.
.经上述实验后得到油酸甲酯15.40g,则该实验中生物柴油(全以油酸甲酯计量)的产率为57.8%%.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
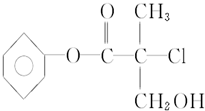 某有机物X是农药生产中的一种中间体,其结构简式如图:
某有机物X是农药生产中的一种中间体,其结构简式如图: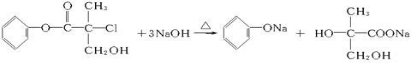 +NaCl+H2O.
+NaCl+H2O.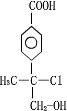 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和 14N 质子数相差 1,中子数也相差1 | |
| B. | 一种元素可以有多种核素,有几种核素就有几种原子 | |
| C. | 钴5627Co、5727Co、5827Co、5927Co等几种原子,他们是同素异形体,其物理性质几乎相同,化学性质不同 | |
| D. | 核聚变如21H+31H→42He+10 n,由于有新微粒生成,该变化是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
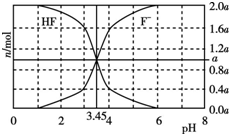 25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3时,溶液中:c(Na+)<c(F-) | |
| B. | 当c(F-)>c(HF)时,一定有c(OH-)>c(H+) | |
| C. | pH=3.45时,NaOH溶液与HF恰好完全反应 | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | 全部 | C. | ②④⑤ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com