
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 教材中用纸层析法分离Fe3+和Cu2+实验,滤纸上吸附的丙酮作为固定相,水作为流动相 |
分析 A.二者均与硝酸银反应生成白色沉淀;
B.冷却速度慢,则易析出晶体,越慢晶体析出越大;
C.乙醇与乙酸互溶;
D.滤纸作为惰性支持物,滤纸上吸附的水作为固定相.
解答 解:A.二者均与硝酸银反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.重结晶时,冷却速度慢时,可使溶液的过饱和度缓慢释放,使晶体有充足的时间生长,所以得到的晶体颗粒越大,故B正确;
C.乙醇和乙酸是互溶的,不分层,所以无法用分液法分离,且沸点相近,直接蒸馏分离效果也不理想,一般加入NaOH后蒸馏出乙醇,再加硫酸,蒸馏出乙酸,故C错误;
D.教材中用纸层析法分离Fe3+和Cu2+实验,滤纸上吸附的水作为固定相,丙酮作为流动相,故D错误;
故选B.
点评 本题考查物质的检验与鉴别,为高频考点,把握物质的性质、性质差异及发生的反应和现象是解答该题的关键,选项BD为解答的难点,注意元素化合物知识的综合应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- | |
| D. | 该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
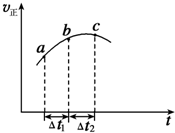 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Na+、ClO-、SO42-、Fe2+ | ||
| C. | Ba2+、K+、HCO3-、NO3- | D. | Ba2+、Na+、SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中.Na+一定存在,且浓度为0.1mol/L | |
| B. | 该溶液中CO32-和SO42-一定存在,且物质的量浓度均为0.1mol/L | |
| C. | Ba2+一定不存在 | |
| D. | NH4+ 一定存在,且100mL溶液中物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题: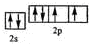 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱-NaHCO3 | B. | 胆矾-CuSO4 | C. | 醋酸-CH3COOH | D. | 生石灰-CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com