
【题目】将 4molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g),若经 2s后测得C的浓度为 0.6molL-1,现有下列几种说法:
2C(g),若经 2s后测得C的浓度为 0.6molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3molL-1s-1
②物质 B的体积分数是40%
③2s 时物质 A 的转化率为30%
④2s 时物质 B 的浓度为 1.0molL-1
其中正确的是( )
A. ①④ B. ①③ C. ②③ D. ③④
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是 ( )
A. 溶液与胶体:不同的本质原因是能否发生丁达尔效应
B. 纯净物与混合物:是否仅含有一种元素
C. 氧化还原反应:元素化合价是否变化
D. 电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为中学化学中的一种盐,B、C为日常生活中常见的金属,离子有相同化合价。通常条件下D为无色无味气体,无色气体G遇空气变红棕色。已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液。各物质之间的转化关系如下图(部分反应产物已略去)。

请回答下列问题:
(1)A的化学式为__________。
(2)A溶液与Na 2 O 2 反应的总化学方程式为__________。
(3)E的稀溶液与F溶液反应的离子方程式为__________。
(4)若向100mL盐A的溶液中加入10g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16g固体,则滤液中溶质的物质的量浓度为__________。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下:
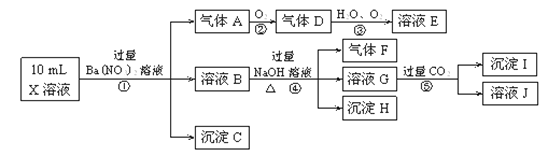
根据以上信息,回答下列问题:
(1)反应③的化学方程式为________________________。
(2)沉淀C、H和气体F的化学式分别为____________________。
(3)写出有关反应的离子方程式:
①中生成A_____________________。⑤________________________。
(4)上述离子中,溶液X中肯定不含有的离子是_______________,可能含有的离子是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 活化分子间的碰撞一定是有效碰撞
B. 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加
C. 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据
D. 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10﹣7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. Na2SO4=2Na++S04-2 B. Ba(OH)2=Ba2++OH-2
C. Al2(SO4)3=2A13++3SO42- D. Ca(N03)2=Ca2++2(N03) 2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
⑴将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO2-4,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
⑵pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: 。
⑶ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式: 。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com