
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
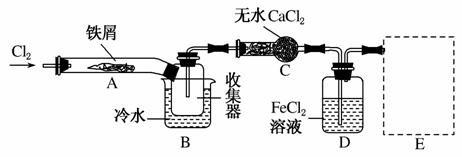
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为________________________ ________________________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是__________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为____________________________ __________________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:________________________________________________________________________。
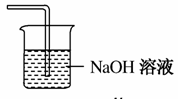
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为________________________________________________________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为________________________________________________________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②_________________________________________________________。
解析 (2)FeCl3受热易升华,因此在沉积的FeCl3固体下方加热即可。(3)防止FeCl3潮解主要是防止其与水接触,步骤②中通入的是干燥的Cl2,并把空气赶出装置;步骤⑤中用的是干燥的N2,并把收集器密封。(4)装置B中的冷水浴显然是为了使升华的氯化铁冷却为固体,便于收集;检验FeCl2是否失效,就是检验溶液中是否含有Fe2+,可使用K3溶液,若生成蓝色沉淀则说明含有Fe2+,即未失效。(5)一般用氢氧化钠溶液吸收多余的氯气,并将导管插入液面下。(6)FeCl3具有氧化性,H2S具有还原性,二者发生氧化还原反应。(7)电解池中含有HCl和FeCl2。由于阳极发生氧化反应且还原性:Fe2+>Cl-,所以是Fe2+在阳极放电,生成Fe3+。(8)实验Ⅱ中,FeCl3吸收H2S变为FeCl2,再经过电解重新得到FeCl3,FeCl3可以循环使用。
答案 (1)2Fe+3Cl2===2FeCl3
(2)在沉积的FeCl3固体下方加热
(3)②⑤
(4)冷却,使FeCl3沉积,便于收集产品 干燥管
K3溶液
(5)
(6)2Fe3++H2S===2Fe2++S↓+2H+
(7)Fe2+-e-===Fe3+
(8)FeCl3得到循环利用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列说法错误的是( )
A.浓H2SO4、浓HNO3均能使Fe钝化
B.Na2SO3溶液与BaCl2溶液相混合,有白色沉淀生成,加稀盐酸后沉淀消失
C.将SO2通入CaCl2溶液中,有白色沉淀生成
D.工业上制备硝酸的主要设备是热交换器、转化器和吸收塔
查看答案和解析>>
科目:高中化学 来源: 题型:
将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O═2HBr+H2SO4,反应中转移的电子数和还原剂是( )
|
| A. | 2e﹣,H2SO4 | B. | 4e﹣,SO2 | C. | 2e﹣,Br2 | D. | 2e﹣,SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
|
| A. | 9.0 L | B. | 13.5 L | C. | 15.7 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
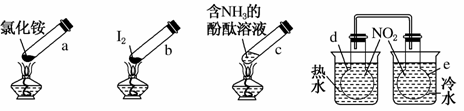
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。则下列说法中正确的是( )

A.X元素可能为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
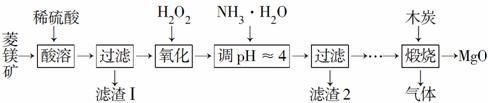
(1)MgCO3与稀硫酸反应的离子方程式为___________________ _____________________________________________________________________________________________________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)滤渣2的成分是____________________________________________ _________________________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C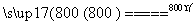 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C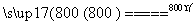 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C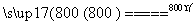 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。
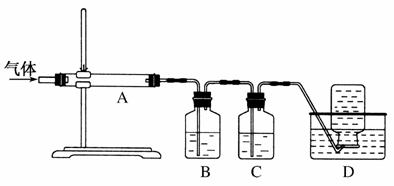
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制备Al2O3、K2FeO4和H2SO4的工艺流程如下: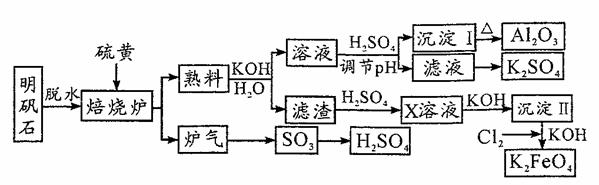
请回答下列问题:
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S =2Al2O3 +9SO2,该反应中氧化剂与还原剂的物质的量之比是 _ 。若生成102g Al2O3,转移的电子数目为 。
(2)写出化学式:沉淀Ⅰ是 ,沉淀Ⅱ是 ___________ 。
(3)熟料溶解时反应的离子方程式为______________________________________________。
(4)溶液经加硫酸调节pH后,过滤、洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 。
(5)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式:
______________________________________ 。
(6)“焙烧”过程中生成的SO2可用于制H2SO4。已知25℃,101kPa时:
2SO2(g) + O2(g)  2SO3 (g) △H1=-197.0kJ•mol-1
2SO3 (g) △H1=-197.0kJ•mol-1
H2O(g)=H2O(l) △H 2=-44.0 kJ·mol-1
2SO2(g) + O2(g) + 2H2O(g) =2H2SO4 (l) △H3=-545kJ•mol-1
则SO3 (g)和H2O(l)反应的热化学方程式为 _________ 。
(7)本工艺流程中可循环物质为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A-D是中学化学实验中常见的几种温度计装置示意图,正确的是:
A.酒精和浓硫酸混合加热制乙烯 B.石油分馏实验
C.苯跟溴的取代反应 D.电石跟水反应制乙炔
| A | B | C | D |
|
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com