
氨气分了空间构型是三角锥形,而甲烷是正四而体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气的相对分子质量大于甲烷
科目:高中化学 来源:2016届西藏日喀则地区一中高三10月月考理综化学试卷(解析版) 题型:填空题
【化学一物质结构与性质】(15分)周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基志原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:

(1)写出Z的基态原子外围电子排布__________。
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如上图所示:在Am-中,R原子轨道杂化类型有_______;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为____________。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是_______。
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为____g•cm-3。(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期二调化学试卷(解析版) 题型:选择题
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后的溶液最多还能溶解1.4 g Fe
B.反应后溶液中c(N03-) =0.85 mol/L
C.反应后溶液中铁元素可能以Fe2+形式存在
D.1.12 L气体可能是NO、NO2的混合气体
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上第二次段考化学试卷(解析版) 题型:选择题
下列与金属腐蚀有关的说法正确的是

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二10月月考化学试卷(解析版) 题型:填空题
(10分)Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大。Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d104s1。
(1)W位于元素周期表第_______周期第________族,W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(2)XQ3分子的空间构型为_______,所含化学键类型为________共价键(填“极性”或“非极性”)。
(3)Z基态原子核外电子排布式是______________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为______________。
(4)已知:
①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第四次大考化学试卷(解析版) 题型:填空题
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
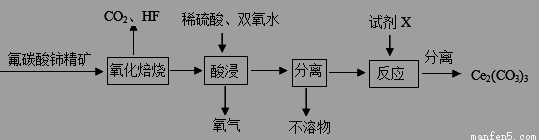
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1.00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第四次大考化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+ H2O +CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O
C.Fe2(SO4)3的酸性溶液中通入足量硫化氢 Fe3++H2S=Fe2++S↓+2 H+
D.氯化亚铁溶液中加入稀 硝酸 3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
硝酸 3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三复习班上月考化学试卷(解析版) 题型:选择题
下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是
A.2Na + 2NH3 → 2NaNH2 + H2↑ B.NH3 + HNO3→ NH4NO3
C.4NH3 + 6NO → 5N2 + 6H2O D.3SiH4 + 4NH3 → Si3N4 + 12H2
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省五校协作体高三上学期期初考试化学试卷(解析版) 题型:选择题
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为
A.X>Y>Z>M B.X>Z>Y>M
C.M>Z>X>Y D.X>Z>M>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com