
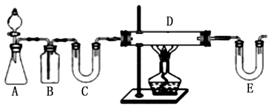

分析 步骤一:方案1:按如图中装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化铁生成氯化亚铁;
方案2:由FeCl3溶液制取FeCl2溶液,可以在氯化铁溶液中加入足量铁粉;
步骤二:根据配制一定物质的量浓度溶液的操作步骤可知,配制溶液是需要500 mL容量瓶、胶头滴管、量筒、玻璃棒、烧杯等,在操作滴定管时应用左手握住活塞,手指在另上侧拧开活塞,根据氧化还原滴定原理可以进行误差分析;
步骤三:根据实验步骤可知,实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能,在酸性条件下H2O2将SCN-氧化成SO42-和氮气,同时有二氧化碳生成,据此书写离子方程式;
解答 解:步骤一:方案1:按如图中装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化铁生成氯化亚铁,所以E中盛放的试剂是碱石灰,D中反应的化学方程式为 H2+2FeCl3=2FeCl2+2HCl,根据装置图可知,此方案有个明显的缺陷是没有处理尾气H2,
故答案为:碱石灰;H2+2FeCl3=2FeCl2+2HCl;没有处理尾气H2;
方案2:由FeCl3溶液制取FeCl2溶液,可以在氯化铁溶液中加入足量铁粉,其操作为向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,
故答案为:向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液;
步骤二:根据配制一定物质的量浓度溶液的操作步骤可知,配制溶液是需要500 mL容量瓶、胶头滴管、量筒、玻璃棒、烧杯等,在操作滴定管时应用左手握住活塞,手指在另上侧拧开活塞,故选 A,
在氧化还原滴定中:
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势,会使标准液的浓度偏高,导致消耗的标准液的体积偏小,会使测定的FeCl2溶液浓度偏小,故A正确;
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,使标准液的体积偏大,会使测定的FeCl2溶液浓度偏大,故B错误;
C.锥形瓶洗净后未干燥,对实验没有影响,故选A;
故答案为:500 mL容量瓶、胶头滴管;A; A;
步骤三:根据实验步骤可知,实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能,在酸性条件下H2O2将SCN-氧化成SO42-和氮气,同时有二氧化碳生成,反应的离子方程式为2SCN-+11H2O2═2SO42-+2H++2 CO2↑+N2↑+10 H2O,
故答案为:排除H2O2分解产生的O2氧化SCN-的可能;2SCN-+11H2O2═2SO42-+2H++2 CO2↑+N2↑+10 H2O.
点评 本题亚铁离子和铁离子的有关性质以及之间的转化、实验过程分析及实验基本操作,主要是物质性质和离子检验的理解应用,题目难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题

| A. | 闭合K1,断开K2,可防止Fe发生吸氧腐蚀 | |
| B. | 闭合K1,断开K2,Cl-向石墨电极移动 | |
| C. | 闭合K2,断开K1,可用于制备家用消毒液(主要成分NaClO) | |
| D. | 闭合K2,断开K1,电解质溶液中Na+的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HCl Cu(OH)2+CH3COOH | |
| B. | NaHCO3+H2SO4 Na2CO3+HCl | |
| C. | NaHCO3+NaOH Ca(HCO3)2+NaOH | |
| D. | BaCl2+H2SO4 Ba(NO3)2+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)=c(OH-) | |
| B. | 常温下等体积pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 | |
| C. | 常温下,醋酸钠与醋酸的混合溶液pH=7:则c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 700C时,向纯水中加人H3PO4后,水的Kw减小 | |
| B. | 700C的Na2CO3溶液中c(Na+)>c(CO32-)c(HCO3-)>c(OH-)>c(H+) | |
| C. | 700C的H2S04溶液中c(H+)=c(OH-)+2c(SO42-) | |
| D. | 将室温下0.1 mol/L的NaOH溶液加热至700C时,c(OH-)/c(H+)随之增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
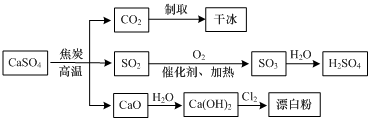
| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 | |
| B. | 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com