
某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为( )
| A.1∶2 | B.2∶1 | C.1∶3 | D.3∶1 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y+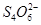 +2H2O下列说法中,不正确的是 ( )
+2H2O下列说法中,不正确的是 ( )
| A.S2O32-是还原剂 | B.Y的化学式为Fe2O3 |
| C.a=4 | D.每有1mol O2参加反应,转移的电于总数为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | | Cl- |
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | / | Cl2 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将0.39g锌粉加入到20.0 mL的0.200 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M+ | B.M2+ | C.M3+ | D.MO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知常温下在溶液中可发生如下两个离子反应:
Ge4++Fe2+=Fe3++Ge3+①;Sn2++2Fe3+=2Fe2++Sn4+②
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室制取少量N2,常利用的反应是:NaNO2+NH4Cl NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
| A.NaNO2是氧化剂,发生还原反应 |
| B.生成1mol N2时转移的电子数为6mol |
| C.NH4Cl中的N元素被还原 |
| D.N2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在KClO3+6HCl KCl+3Cl2↑+3H2O中,被还原的氯元素和被氧化的氯元素的
KCl+3Cl2↑+3H2O中,被还原的氯元素和被氧化的氯元素的
物质的量之比是
| A.1 : 6 | B.1 : 5 | C.5 : 1 | D.6 : 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
| A.该未知物X为Na2SO4 |
| B.该反应的氧化剂是KIO3 |
| C.该反应中,发生氧化反应的过程是KIO3→I2 |
| D.由反应可知还原性强弱顺序为:Na2SO3>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1 mol Cr2O72-反应所需PbO2的物质的量为
| A.3.0 mol | B.1.5 mol | C.1.0 mol | D.0.75 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com