
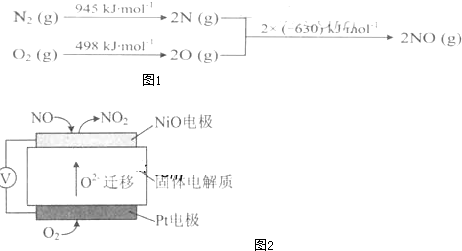
| ||
| ||


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
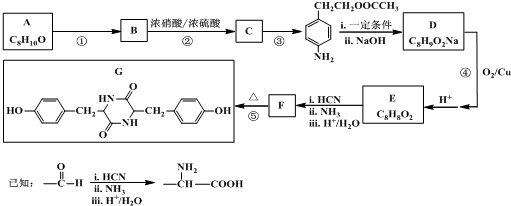
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫与氯气混合后漂白性将会减弱甚至消失 |
| B、蛋白质,油脂,纤维素是天然的高分子材料 |
| C、聚乙烯塑料制品可用于食品的包装 |
| D、次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
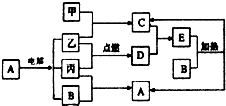 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
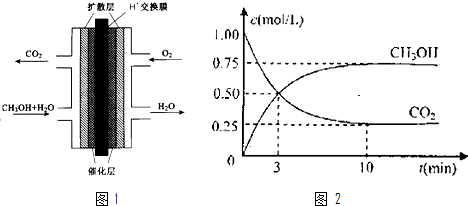
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com