
反应C(s)+H2O(g)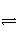
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器的容积变大
A.①③ B.①④ C.②③ D.②④
科目:高中化学 来源: 题型:
苹果酸的结构简式为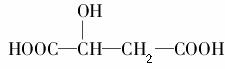 ,下列说法正确的是( )。
,下列说法正确的是( )。
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D.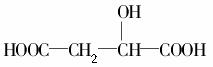 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还原法。由于三氯氢硅氢还原法具有一定优点,被广泛应用。其简化的工艺流程如下图所示:
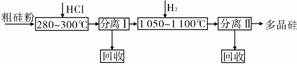
(1)由纯SiHCl3制备高纯硅的化学方程式为________________。该生产工艺中可以循环使用的物质是____________________(写出两种)。
(2)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法,工业上广泛采用的合成硅烷的方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,反应的化学方程式是______________________(不需注明反应条件,下同);整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为_____________ _____;整个系统必须与空气隔绝,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组将一定质量的镁铝合金材料投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的关系如图所示。
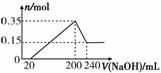
请回答下列问题:
(1)该合金材料中,镁、铝的物质的量之比为______。
(2)硫酸的物质的量浓度为______。
(3)另取相同质量的该合金材料与7.8 g Na2O2一起投入足量的H2O中,最终产生的气体在标准状况下的体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量的ClO2,这是因为( )
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出的ClO2使反应生成物的浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2。对此反应的下列叙述中正确的是( )
A.使用催化剂能加快反应的速率
B.使一种反应物过量能提高反应的速率
C.改变压强对反应速率没有影响
D.降低温度能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y===2Z,如图所示是该反应中X的物质的量随时间变化的曲线。
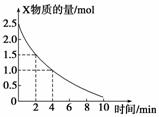
(1)分别求出2 min内和4 min内的平均速率。
(2)从(1)中数据可以得出什么结论?
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的打“√”,错误的打“×”
(1)任何温度下,水溶液中c(H+)和c(OH-)的相对大小都可判断溶液的酸、碱性( )
(2)弱电解质的导电能力一定比强电解质的导电能力弱( )
(3)某盐溶液呈酸性,一定是由水解引起的( )
(4)水解方程式都必须写“”( )
(5)AgCl(s)溶解平衡常数表达式为Ksp=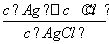 ( )
( )
(6)沉淀转化只能是Ksp大的沉淀转为Ksp小的沉淀( )
(7)中和等体积、等pH的盐酸和醋酸消耗的NaOH的量相同( )
(8)制备无水AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法( )
(9)用湿润的pH试纸测得某溶液的pH=3.4( )
(10)在NaHCO3溶液中加入NaOH,不会影响离子的种类( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com