
下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
C | 乙烯可与KMnO4溶液发生反应 | 乙烯具有还原性 |
D | 乙醇的沸点比乙酸的沸点高 | 乙醇和乙酸可通过蒸馏初步分离 |
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源:2017届河北省沧州市高三上周测化学试卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置,电极I为Al,其他电极均为Cu,则下列说法正确的是

A.电流方向:电极IV→A→电极I
B.电极I上发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二下期末化学试卷(解析版) 题型:选择题
调味剂是日常生活中离不开的食品添加剂,有关其说法正确的是 ( )。
A. 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
B.食醋的主要成分是醋酸,将一定量的醋酸溶液稀释,溶液中各离子的浓度都减小
C.味精的主要成分是谷氨酸钠,向其中加入盐酸可得谷氨酸,谷氨酸具有两性
D.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学测化学试卷(解析版) 题型:选择题
a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A. a与其他三种元素形成的二元化合物中其化合价均为+1
B. b与其他三种元素均可形成至少两种二元化合物
C. c的原子半径是这些元素中最大的
D. d和a形成的化合物的溶液呈弱酸性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学测化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法错误的是
A.可利用油脂水解制备甘油
B.食用油反复加热会产生芳香族化合物等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.糖、油脂、蛋白质都能水解
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
已知H2(g)+Br2(l)=2HBr(g) △H=-72kJ/mol;蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
H2(g) | Br(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为
A.404 B.260 C.200 D.230
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
下列说法正确的是
A. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料
B. 氢化物的沸点:H2O>NH3>HF
C. 同主族元素从上到下,单质的熔点逐渐降低
D. P的非金属性强于Si,H3PO4比H2SiO3的酸性强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应热ΔH=2×(-57.3)kJ·mol-1
B.1 mol甲烷燃烧生成气态水和二氧化碳气体所放出的热量就是甲烷的燃烧热
C.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周练化学试卷(解析版) 题型:填空题
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解NaCl溶液生成氯气的化学方程式为 。
(2)Cl2溶于H2O、NaOH溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl2与H2O、NaOH的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如图所示:
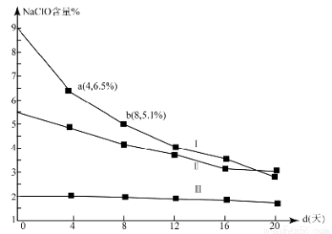
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化学方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com