
| A. | HCl | B. | FeCl2 | C. | KOH | D. | Na2CO3 |
分析 由乙$\stackrel{化合反应}{→}$甲$\stackrel{分解反应}{→}$乙可知,结合选项可知,甲、乙均为化合物,甲→乙发生分解反应,则甲可能为碳酸氢钠,乙可能为碳酸钠,以此来解答.
解答 解:A.若乙为HCl,则不能发生化合反应生成甲,故A不选;
B.若乙为FeCl2,乙→甲的化合反应应属于氧化还原反应,但不满足甲$\stackrel{分解反应}{→}$乙,故B不选;
C.甲为化合物,KOH不会通过化合反应生成甲,故C不选;
D.若乙为碳酸钠,碳酸钠、水、二氧化碳发生化合反应生成乙(碳酸氢钠),乙(碳酸氢钠)加热分解生成碳酸钠,故D选;
故选D.
点评 本题考查无机物的推断,为高频考点,明确发生的化学反应及物质的类型是解答本题的关键,注意实现甲分解生成乙的过程中发生的反应为非氧化还原反应,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3kJ热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分溶液与胶体 | |
| B. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在10-9~10-7m之间 | |
| C. | 胶体分散质粒子能透过半透膜和滤纸 | |
| D. | Fe(OH)3胶体吸附水中的悬浮颗粒并沉降,达到净水的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
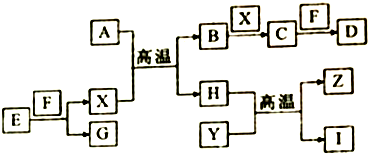
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中,K+、Cl-、AlO2-、NH4+可以大量共存 | |
| B. | 由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH- | |
| C. | 由0.1 mol•L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂 | |
| B. | 这是一个氧化还原反应,Na2O2是氧化剂,CO2是还原剂 | |
| C. | 这是一个氧化还原反应,Na2O2是还原剂,CO2是氧化剂 | |
| D. | 这是一个置换反应,有单质O2产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
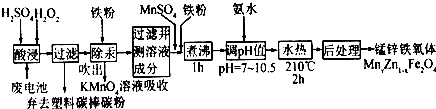
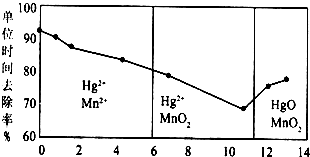
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯可以装入钢瓶中贮存 | |
| B. | 氯水可漂洗衣服上的墨渍 | |
| C. | 实验室使用的氯水要装在棕色瓶中,并且随配随用 | |
| D. | 实验室可利用强氧化剂如KMnO4、KClO3等与浓HCl反应的原理制Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com