
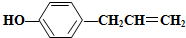 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 1 mol胡椒粉最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒粉最多可与3 mol溴水发生反应 | |
| C. | 胡椒粉可与氯化铁溶液反应,使溶液呈紫色 | |
| D. | 胡椒粉与NaHCO3溶液反应产生CO2 |
科目:高中化学 来源: 题型:选择题
| A. | 体积分数75%的乙醇溶液常用于医疗消毒 | |
| B. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得各种烷烃、苯及其他衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
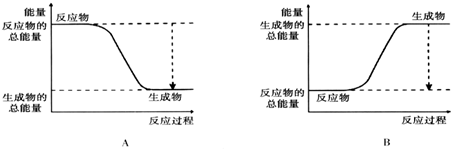
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、丙三醇都是无色溶于水的有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
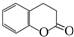 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(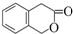 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| B. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| C. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| D. | 常温下,4gCH4含有NA 个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
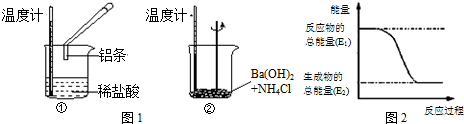
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com