
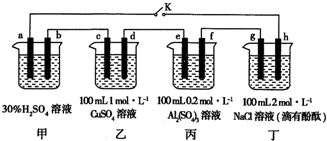
分析 甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现G电极附近的溶液变红,说明G电极是电解池的阴极,H是电解池的阳极;所以a为正极,b为负极;c电极为阴极,d为阳极;e电极为阴极,f为阳极;20min后,将K断开,此时c、d两极上产生的气体体积相同,
(1)依据分析判断电极名称;
(2)丙中电解水;
(3)时c、d两极上产生的气体体积相同,c电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑,d电极上发生的电极反应为:4OH--4e-=2H2O+O2↑,根据电子守恒计算生成的Cu、氢气和氧气的物质的量;
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,氢气在c极失电子,氧气在d极得电子;
(5)电解后丁装置中的溶液为氢氧化钠,根据转移电子守恒计算生成NaOH的浓度,加醋酸生成醋酸钠溶液,结合Ka=$\frac{[C{H}_{3}CO{O}^{-}]•[{H}^{+}]}{[C{H}_{3}COOH]}$计算.
解答 解:甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现G电极附近的溶液变红,说明G电极是电解池的阴极,H是电解池的阳极;所以a为正极,b为负极;c电极为阴极,d为阳极;e电极为阴极,f为阳极;20min后,将K断开,此时c、d两极上产生的气体体积相同,
(1)a电极是铅蓄电池的正极,正极的电极材料是PbO2;
故答案为:PbO2;
(2)丙中电解硫酸铝,其实际上是电解水,其电解方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
故答案为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(3)时c、d两极上产生的气体体积相同,c电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑,d电极上发生的电极反应为:4OH--4e-=2H2O+O2↑,
设生成的氧气为xmol,则氢气也为xmol,生成的Cu为0.1L×1mol/L=0.1mol,由得失电子可得:2x+0.1×2=4x,解得x=0.1mol,
则电解时生成0.1mol氢气、0.1mol氧气和0.1molCu,若要恢复到原来的状态,需要加入0.1molCu(OH)2;
故答案为:0.1molCu(OH)2;
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,氢气在c极失电子,c为负极,氧气在d极得电子,正极的反应为:O2+4H++4e-=2H2O;
故答案为:负;O2+4H++4e-=2H2O;
(5)电解后丁装置中的溶液为氢氧化钠,乙中电解生成0.1mol氧气,转移电子为0.4mol,则氯化钠被全部电解,则生成的氢氧化钠为0.2mol,其浓度2mol/L,加醋酸后溶液的pH恰好等于7,则c(H+)=c(OH-),由电荷守恒可知c(Na+)=c(CH3COO-)=$\frac{2mol/L×a×1{0}^{-3}L}{(a+b)×1{0}^{-3}L}$=$\frac{2a}{a+b}$mol/L,
c(CH3COOH)=$\frac{2mol/L×b×1{0}^{-3}L}{(a+b)×1{0}^{-3}L}$-c(CH3COO-)=$\frac{2(b-a)}{a+b}$mol/L,Ka=$\frac{[C{H}_{3}CO{O}^{-}]•[{H}^{+}]}{[C{H}_{3}COOH]}$=$\frac{\frac{2a}{a+b}×1{0}^{-7}}{\frac{2(b-a)}{a+b}}$=1.75×10-5,解得$\frac{a}{b}$=$\frac{175}{176}$;
故答案为:$\frac{175}{176}$.
点评 本题考查了原电池和电解池原理、电离常数在计算中的应用等,正确判断原电池正负极和电解池的阴阳极、以及电极方程式的书写方法是解本题关键,根据离子放电顺序确定阴阳极电极反应,并结合得失电子守恒解答,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4是氧化产物 | B. | N2H4中存在极性键和非极性键 | ||
| C. | 配平后,OH-的化学计量数为2 | D. | 生成3.2gN2H4转移0.lmol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在催化剂存在条件下乙烯与溴反应制 1,2-二溴乙烷 | |
| B. | 在一定条件下苯与氢气反应制取环己烷 | |
| C. | 甲苯使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O中含有的分子数为NA | |
| B. | 28g N2中含有的分子数为NA | |
| C. | 1mol Mg与足量稀盐酸反应转移的电子数为NA | |
| D. | 1L 1mol•L-1 Na2 CO3溶液中含有的钠离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++H++SO42- | B. | AgCl═Ag++Cl- | ||
| C. | Ba (OH)2═Ba2++2OH- | D. | CH3COONH4?NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是硫及其某些硫化物在空气中燃烧的产物 | |
| B. | SO2具有漂白作用,也有防腐作用 | |
| C. | SO2是硫酸的酸酐,称为硫酐 | |
| D. | SO2是一种大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


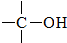 +
+ $→_{△}^{H_{2}SO_{4}(浓)}$
$→_{△}^{H_{2}SO_{4}(浓)}$ +H2O
+H2O +R′CHO$\stackrel{一定条件}{→}$
+R′CHO$\stackrel{一定条件}{→}$
 .
. .
. .
.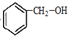 ,名称是苯甲醇.
,名称是苯甲醇. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com