
| A. | 液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛溶液的体积 | |
| B. | 在过氧化钠固体中,阴离子与阳离子的个数 | |
| C. | 将质量分数为a%的H2SO4溶液蒸发水后变为2a%,蒸发前后H2SO4溶液的物质的量浓度 | |
| D. | 在碳与浓硫酸(加热)的反应中,被还原的H2SO4与参加反应的H2SO4的物质的量 |
分析 A.滴定管最大数值下面还有溶液,其体积未知;
B.过氧化钠中阴离子是过氧根离子;
C.依据C=$\frac{1000ρω}{M}$判断;
D.依据方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O判断;
解答 解:A.滴定管最大值下面还有溶液,且这部分溶液的体积未知,导致无法计算其溶液体积的比值,故A错误;
B.过氧化钠中阴离子是过氧根离子,在过氧化钠固体中,阴离子与阳离子的个数之比为:1:2,故B正确;
C.依据C=$\frac{1000ρω}{M}$可知,若稀释过程中密度ρ保持不变,则质量分数为a%的H2SO4溶液蒸发水后变为2a%,蒸发前后H2SO4溶液的物质的量浓度之比为1:2,
但是稀释过程中ρ变小,所以≠1:2,故C错误;
D.依据方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O可知硫酸中硫元素化合价都降低,所以浓硫酸都做氧化剂,被还原的H2SO4与参加反应的H2SO4的物质的量相等,故D错误;
故选:B.
点评 本题为综合题,考查了滴定管构造、过氧化钠结构、溶液稀释规律、氧化还原反应基本概念,题目难度综合性较强,涉及知识点较多,难度较大,熟练掌握相关知识是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 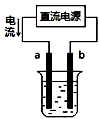 用装置精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 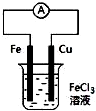 装置的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 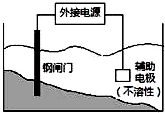 装置中钢闸门应与外接电源的负极相连 | |
| D. | 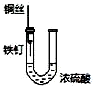 装置中的发生的是铁钉的析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| B. | pH=12的溶液中 NO3-、I-、Na+ | |
| C. | NaHS溶液中 SO42-、K+、Cl-、Al3+ | |
| D. | 使甲基橙变红的溶液中 C6H5O-、K+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在一定条件下苯能与氯气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡并静置后下层液体为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
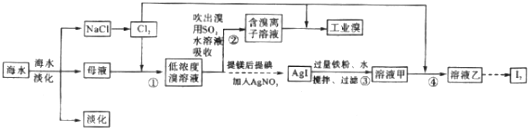
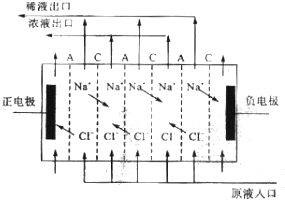
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的理念是从源头上减少和消除工业产生对环境的污染 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com