
| A. | 只有②③ | B. | ①②③ | C. | ②③④ | D. | 全部 |
分析 先根据反应方程式2Fe+3Br2=2FeBr3,2Fe3++2I-=2Fe2++I2 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,判断离子间的氧化性强弱,当离子的氧化性大于铁离子时,亚铁离子才能够被氧化成铁离子,注意在酸性条件下硝酸根离子检验氧化性,据此完成本题.
解答 解:由题中反应方程式可知,离子的氧化性关系为:Br2>Fe3+>I2,HNO3>Fe3+,
①、Fe(NO3)2溶液滴入硫酸中,硝酸根离子在酸性条件下具有氧化性,能够将亚铁离子还原成铁离子,故①正确;
②Fe(NO3)2溶液滴入硝酸中,硝酸检验强氧化性,能发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故②正确;
③Fe(NO3)2溶液滴入溴水中,由于氧化性Br2>Fe3+,所以溴单质能够将亚铁离子氧化成铁离子,故③正确;
④Fe(NO3)2溶液滴入碘水中,由于氧化性Fe3+>I2,所以碘单质不能够氧化亚铁离子,故④错误;
故选B.
点评 本题考查了铁盐与亚铁盐的相互转变、氧化还原反应中氧化性强弱比较等知识,题目难度不大,注意硝酸根离子在酸性条件下具有强氧化性,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 纯铁的抗腐蚀能力比生铁强 | |
| B. | 可用酒精洗涤附着在试管内壁上的固态硫 | |
| C. | 用惰性电极电解熔融NaCl可获得金属钠 | |
| D. | 二氧化硅能与NaOH溶液反应,所以盛放碱液的试剂瓶不能用磨口玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把40gNaOH溶解于1L水中即得到1mol/L的NaOH溶液 | |
| B. | 将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液 | |
| C. | 配制0.2mol/L的CuSO4溶液480mL,需硫酸铜晶体的质量为25g | |
| D. | 配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
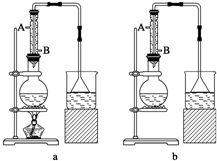
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂1mol A-A键和1mol B-B键能放出xkJ的能量 | |
| C. | 断裂2mol A-B键需要吸收ykJ的能量 | |
| D. | 2mol AB的总能量高于1 mol A2和1mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
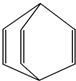
| A. | 桶烯能在NaOH水溶液中发生加成反应 | |
| B. | 桶烯中的一个氢原子被氯原子取代,所得产物有2种 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯在一定条件下能发生缩聚反应形成高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com