
| 陈述Ⅰ | 陈述Ⅱ | |
| A | BaSO4难溶于水 | SO2气体通入Ba(NO3)2溶液中沉淀 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2气体通入Ba(NO3)2发生氧化还原反应生成BaSO4沉淀;
B.非金属性:Cl>S,可比较最高价氧化物水化物的酸性;
C.由溶解度可分析饱和溶液晶体析出的原因;
D.SO2为酸性氧化物.
解答 解:A.SO2气体通入Ba(NO3)2发生氧化还原反应生成BaSO4沉淀,陈述Ⅰ和Ⅱ均正确,但不存在因果关系,故A不选;
B.非金属性:Cl>S,可比较最高价氧化物水化物的酸性,陈述Ⅰ正确,Ⅱ错,不存在因果关系,故B不选;
C.由溶解度可分析饱和溶液晶体析出的原因,陈述Ⅰ和Ⅱ均正确,并存在因果关系,故C选;
D.SO2为酸性氧化物,陈述Ⅰ正确,Ⅱ错误,不存在因果关系,故D不选;
故选C.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及相关反应原理为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加蒸馏水 | B. | 加浓盐酸 | C. | 加AgNO3溶液 | D. | 加氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
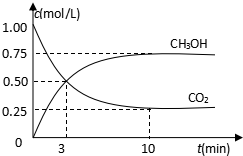 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 使用容量瓶前检查它是否漏水 | |
| D. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
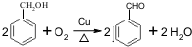
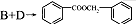 的化学方程式为
的化学方程式为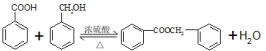
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X只能形成一种氢化物 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(X)>r(Y) | |
| C. | 化合物Q中存在两种类型的共价键 | |
| D. | X与Z形成的化合物在熔融状态下能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 78g过氧化钠晶体中,含3NA个离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com