
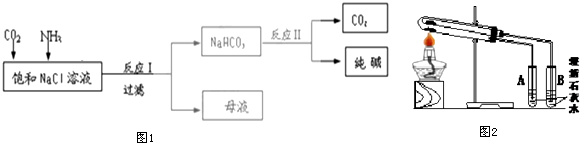
分析 侯氏制碱法的原理是在氨化饱和的氯化钠溶液里通入过量的CO2,因碳酸氢钠的溶解度比碳酸钠小,会有碳酸氢钠析出,过滤后将碳酸氢钠加热分解,可得到纯碱碳酸钠,同时生成的CO2可循环利用,据此分析作答;
(1)制备碳酸氢钠里需要的原料是氯化钠饱和溶液、NH3和CO2,后续操作过程中碳酸氢钠分解生成CO2,NH4Cl和浓碱液反应可产生NH3,都可以循环利用;
(2)碳酸氢钠分解生成碳酸钠、水和二氧化碳;
(3)如果碳酸氢钠加热分解不完全,继续加热会有二氧化碳生成,石灰水会变浑浊;若开始时两试管中加入的固体质量相等,充分加热后,B试管中产生的沉淀的质量是A中的2倍(假设澄清石灰水足量),可假设B中生成的CO2是2mol,则A中生成的CO2是1mol,可结合化学方程式进行计算原碳酸氢钠的分解率.
解答 解:(1)碳酸氢钠分解生成的二氧化碳及NH4Cl和浓碱液反应可产生NH3可以循环利用,故答案为:CO2、NH3;
(2)碳酸氢钠受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+C02↑+H2O,故答案为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+C02↑+H2O;
(3)若A中出现浑浊,说明A中固体仍能受热分解生成二氧化碳,可说明Ⅱ中灼烧的分解不完全;假设B中生成CO2为2mol,则根据2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+C02↑+H2O,可知B中NaHCO3的物质的量为4mol,质量为4mol×84/mol=336g,则A中固体质量也为336g,继续加热分解可得1molCO2,可知A中含有未分解的碳酸氢钠的物质的量为2mol,质量为2mol×84/mol=168g,A中碳酸钠的质量为336g-168g=168g,设反应Ⅱ中已经分解的碳酸氢钠质量为mg,
2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+C02↑+H2O
168g 106g
mg 168g
$\frac{168g}{mg}=\frac{106g}{168g}$,解得m=266.3g,则碳酸氢钠的分解率为$\frac{266.3g}{266.3g+168g}×100%$=61.4%,
故答案为:A;61.4%.
点评 本题以侯氏制碱法为载体,探究碳酸氢钠的分解百分率以及常见气体的检验,基础考查,难度不大,但对学生分析问题解决问题的能力要求较高,建议重视双基复习.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
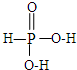 ,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.
,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol的K+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 1.0mol的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| C. | 将氢气在某气体中点燃,若产生苍白色火焰,则该气体为氯气 | |
| D. | 待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com