
【题目】下列说法可以证明反应![]()
![]() 已达到平衡状态的是
已达到平衡状态的是![]()
A.1个![]() 分解的同时,有3个
分解的同时,有3个![]() 的形成
的形成
B.1个![]() 分解的同时,有3个
分解的同时,有3个![]() 的分解
的分解
C.1个![]() 分解的同时,有1个
分解的同时,有1个![]() 的分解
的分解
D.1个![]() 分解的同时,有2个
分解的同时,有2个![]() 的形成
的形成
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是( )
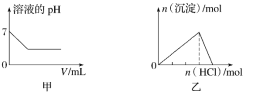
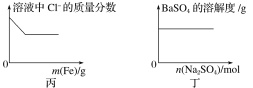
A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
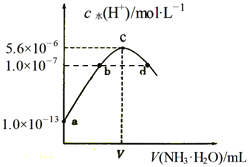
A. V=40
B. c点所示溶液中:c(H+ )-c(OH-)=2c(NH3·H2O)
C. NH3·H2O的电离常数K=10-4
D. d点所示溶液中:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ____________,ΔH__0(填“<”“ >”或“ =”)。
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时C的物质的量为_____;则反应达到平衡时,A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____(填“增大”“减少”或“不变”)。
(3)1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为_______。
A(g)+B(g)的平衡常数的值为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___,溶液中c(Na+)___c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈___,醋酸体积___氢氧化钠溶液体积。
(4)常温下,Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分揽拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1。则c(Pb2+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.在平衡体系PCl5(g)![]() PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
B.CH3COOH与H18O-CH2CH3发生酯化反应是可逆反应,达到平衡后,18O一定仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里
C.在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃
D.CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种分解海水制氢气的方法为2H2O(l) ![]() 2H2(g)+O2(g)。下图为此反应的能量变化示意图,则下列说法错误的是
2H2(g)+O2(g)。下图为此反应的能量变化示意图,则下列说法错误的是
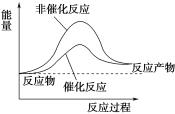
A.该反应正反应的活化能小于逆反应的活化能
B.TiO2可以提高H2O的分解速率
C.催化剂对该反应的反应热无影响
D.使用氢气作燃料有利于控制温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(AgCl),Ksp(AgCl) =1×10-12,如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
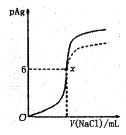
A.原AgNO3溶液的物质的量浓度为0.1mol·L-1
B.图中x点表示溶液中c(Ag+)=c(Cl-)
C.图中x点的坐标为(10,6)
D.把0.1mol·L-1 的 NaCl换成 0.1 mol·L-1 NaI,则图象在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有___________、__________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有___________;但溶液的pH不能超过8,其理由是_____________________。
(4)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com