
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1
图2
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
【答案】-99 +41 答案见解析 a 反应①为放热反应,升高温度使其平衡向逆反应方向移动,平衡常数K应减小 减小 由图2可知,压强恒定时,随着温度的升高,α(CO)减小 p3>p2>p1 温度恒定时,反应①为气体分子数减小的反应,加压使平衡向正反应方向移动,α(CO)增大,而反应③为气体分子数不变的反应,加压对其平衡无影响,故增大压强时,有利于α(CO)增大
【解析】
(1)根据反应①,ΔH1=[E(C≡O)+2E(H—H)]-[3E(C—H)+E(C—O)+E(H—O)]=[1076 kJ·mol-1+2×436 kJ·mol-1]-[3×413 kJ·mol-1+343 kJ·mol-1+465 kJ·mol-1]= -99 kJ·mol-1;根据盖斯定律,②-①可得反应③,ΔH3=ΔH2-ΔH1=-58 kJ·mol-1-(-99 kJ·mol-1)=+41 kJ·mol-1。
正确答案:-99;+41。
(2)根据化学平衡常数的概念可写出反应①K的表达式K=![]() ;由第一小题计算
;由第一小题计算
可知反应①是放热反应,升高温度,化学平衡向逆反应方向移动,化学平衡常数K减小,因此曲线a符合。
正确答案:K=![]() ;a 。
;a 。
(3)由图2可知,压强不变时,随着温度的升高,α(CO)减小;反应③为气体分子数不变
的反应,加压对其平衡无影响;反应①为气体分子数减小的反应,加压α(CO)增大;由图2可知,固定温度(如530 K)时,p1→p2→p3,α(CO)增大,因此综合分析可知p3>p2>p1。
正确答案:减小;由图2可知,压强恒定时,随着温度的升高,α(CO)减小; p3>p2>p1; 温度恒定时,反应①为气体分子数减小的反应,加压使平衡向正反应方向移动,α(CO)增大,而反应③为气体分子数不变的反应,加压对其平衡无影响,故增大压强时,有利于α(CO)增大。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na2O2与H2O反应:2O![]() +2H2O===O2↑+4OH-
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
D.向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1L的密闭容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
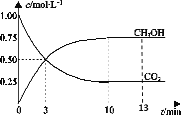
A.T℃时,平衡常数K=3,CO2与H2的平衡转化率相等
B.T℃时,上述条件下达到平衡时放出49.0kJ的热量
C.降温和缩小容器体积均可使反应的平衡常数增大
D.从反应开始到3min,H2的平均反应速率υ(H2)=0.5molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究Cu与浓硝酸反应时发现如下现象:
装置与试剂 | 现象 |
| Cu片完全溶解,产生红棕色气体,得到绿色溶液A,该溶液长时间放置后得到蓝色溶液B。反应后溶液体积几乎不变。 |
(1)Cu与浓硝酸反应的离子方程式为_____。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,然后再持续通入一段时间N2,观察到现象:_____,证实猜测合理。
甲同学为深入研究溶液A呈绿色的原因,查得如下资料并提出了新的假设:

假设一:A中形成了Cu(NO2)![]() 使溶液呈绿色。
使溶液呈绿色。
为了验证假设一的合理性,甲同学进行了如下实验:
(实验一)
操作 | 现象 |
①向20.0mL0.5mol·L-1Cu(NO3)2蓝色溶液中通入少量NO2气体 | 溶液呈绿色 |
②向20.0mL水中通入与①中等量的NO2气体 | 溶液呈无色 |
(3)操作②的目的是_____。
(4)乙同学向①所得溶液中滴加浓硫酸,使溶液中c(H+)达约8mol·L-1,观察到有无色气体放出(遇空气变为红棕色),溶液很快变回蓝色。利用平衡移动原理解释溶液变蓝的原因:_____。
(5)综合甲乙两位同学的实验,假设一不成立。请说明理由:______。
乙同学查得如下资料并提出来另一种假设:
![]()
假设二:A中浓硝酸溶解了NO2所得黄色溶液与Cu2+的蓝色复合形成的绿色。
为验证假设二的合理性,乙同学进行了如下实验:
(实验二)
操作 | 现象 |
①配制与溶液A的c(H+)浓度相同的HNO3溶液,取20.0mL,通入少量NO2气体 | 溶液呈黄色 |
②加入 | 溶液变为绿色 |
③…… | 溶液立即变回蓝色 |
(6)操作②中加入的试剂为_____。
操作③进一步证明了假设二的合理性,写出该操作:span>_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=___________________。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是_______________________________________________。
(2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比____2:1(选填“>”、“<”、“=”),用离子方程式解释其原因______________________。
(3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平)
(4)补全方程式并配平,标出电子转移方向和数目_________________________ 。
(5)该反应中氧化剂和还原剂的物质的量之比是___________。若生成0.2molClO2,转移电子数为_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.01molL-1HA溶液中逐滴加入0.02molL -1MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)。下列说法中不正确的是( )
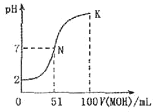
A.MOH为一元弱碱
B.MA稀溶液pH<7
C.N点水的电离程度大于K点水的电离程度
D.K点对应的溶液的pH=10,则c(MOH)+c(OH)-c(H+)=0.01molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷和Cl2(g)反应的能量关系如图所示。下列叙述正确的是

A.PCl5(g)比PCl3(g)稳定B.加入催化剂不会改变△H的大小
C.整个过程吸收的能量为399kJD.PCl3(g)的燃烧热△H=-93kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷基烯酮二聚体(AKD)是造纸工业上常用的一种浆内施胶剂,其结构简式如图所示,下列说法正确的是( )
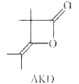
A.AKD的分子式为C8H14O2
B.AKD与NaOH溶液能发生皂化反应
C.AKD分子中所有碳原子处于同一平面
D.AKD能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
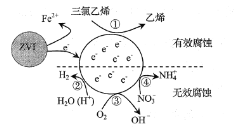
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com