
【题目】Ⅰ.卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如右图所示,则A的结构简式为___________,

请预测B的核磁共振氢谱上应该有__________个峰(信号)。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH水溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是_________________。

②图2是为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,
实验中需要检验的产物是_________________________,
水的作用是________________________________________,
实验现象是___________________________________________。
Ⅱ.下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热装置、铁架台、铁夹等均未画出)。图中:A、无水乙醇(沸点:78.5℃),B、绕成螺旋状的细铜丝或银丝,C、无水硫酸铜粉末,D、碱石灰,E、高锰酸钾,F、蒸馏水

(1)为使A中乙醇平稳转化成乙醇蒸汽,常采用的方法是_________________;
(2)D处碱石灰的作用______________________;
(3)反应后的C处实验现象是: _____________ ;
(4)写出B处发生反应的化学方程式:____________________________________。
【答案】 CH2BrCH2Br 2 使反应物均匀受热;便于控制温度 乙烯或CH2=CH2 除去乙烯中的乙醇,防止干扰乙烯的检验 酸性高锰酸钾溶液褪色 水浴加热A处 防止F中的水蒸气进入C处,干扰实验 由白色变成蓝色 2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
【解析】Ⅰ.(1)核磁共振氢谱中只给出1种峰,说明该分子中只有1种H原子,则A的结构简式为BrCH2CH2Br,B的结构简式为CH3CHBr2,有2种H原子,所以核磁共振氢谱上有2种峰;
(2)①溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失;
②溴乙烷在NaOH乙醇溶液中发生的是消去反应生成乙烯,实验中需要检验的产物是乙烯,乙烯中含有乙醇,可以用水除去乙醇;乙烯能使高锰酸钾溶液褪色。
Ⅱ.(1)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是水浴加热;
(2)碱石灰具有吸水作用,D处使用碱石灰可以防止F中的水蒸气进入C中与无水CuSO4作用,否则会影响产物水的检验;
(3)无水硫酸铜遇到水显示蓝色,可用于检验反应中生成的水,该反应中有水生成,所以C处无水硫酸铜由白色变为蓝色;
(4)乙醇在通过催化剂时,可以被氧化为乙醛,反应的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,。
2CH3CHO+2H2O,。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,37Cl和35Cl是氯的两种同位素,下列说法正确的是()
A. 35Cl原子所含质子数为18
B. ![]() mol的H35Cl分子所含中子数约为6.02×1023
mol的H35Cl分子所含中子数约为6.02×1023
C. 3.5 g的35Cl2气体的体积为2.24 L
D. 35Cl2气体的摩尔质量为70
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
B. 在元素周期表中,s区,d区和ds区的元素都是金属元素
C. 当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,释放能量,由激发态转化成基态
时,释放能量,由激发态转化成基态
D. 非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为化合物的一组是
A. 金刚石、干冰、S02 B. KCI、盐酸、NaOH
C. CuS04·5H20、冰、乙醇 D. 臭氧、CaC03、铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯(C8H10)生产苯乙烯(C8H8),其反应原理是:![]() 下列说法中错误的是
下列说法中错误的是
A. 可用溴的四氯化碳来鉴别乙苯和苯乙烯
B. 乙苯分子中所有原子可能都处于同一平面
C. 苯乙烯可发生氧化反应、取代反应、加成反应
D. 乙苯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是

A. 含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-)
B. 25℃时,0.1mol·L-1醋酸溶液PH=a,0.01mol·L-1醋酸溶液PH=b,则b=a+1
C. 常温下,右图表示以酚酞作指示剂,用0.1mol·L-1NaOH溶液滴定未知浓度的盐酸,滴定至终点时,溶液一定呈中性
D. 向0.1mol·L-1的氨水中加入硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是重要漂白剂,大庆市某高中化学实验探究小组设计如下实验制备亚氯酸钠(NaClO2)晶体。
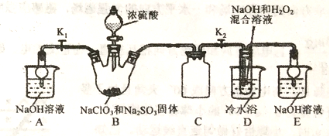
【查阅资料】
I.NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成 NaClO3和NaCl。
II.B中发生的主要反应:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
【进行实验】
(1)盛装NaClO3和Na2SO3固体的仪器名称是_____。
(2)装置C的作用是____________。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作。
①55℃蒸发结晶;②趁热过滤;③38-60℃热水洗涤;④低于____干燥,得到成品。
右图是某同学的过滤操作示意图,其操作不规范的是________(填标号)。
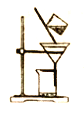
a.将滤纸湿润,使其紧贴漏斗壁
b.滤纸边缘高出漏斗边缘
c.用玻璃棒引流
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
【实验反思】
(1)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______。
(2)实验须使B中NaClO3稍微过量,原因是__________,如NaClO3不足,则装置D中可能产生SO42-,检验装置D中是否含有SO42-的方法是:取少量D中反应后的溶液于试管中,__________,证明溶液中存在SO42-。
(3)测定产品中NaClO2的纯度。测定时进行如下实验:
准确称mg样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。所称取的样品中NaClO2<span lang="EN-US" style="font-size:10.5pt;mso-bidi-font-size:12.0pt;font-family:"Times New Roman","serif";mso-fareast-font-family:"Times New Roman";mso-ansi-language:EN-US;mso-fareast-language:ZH-CN;mso-bidi-language:AR-SA">质量百分含量</span>为_________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各变化中属于原电池反应的( )
A. 在空气中金属铝表面迅速氧化形成保护层
B. 锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C. 红热的铁丝与冷水接触,表面形成蓝黑色保护层
D. 镀锌铁表面有划损时,仍然能阻止铁被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com