
【题目】冬季下雪后,城市道路常使用融雪剂,其主要成分的 化学式为 XY2,X、Y 均为周期表前 20 号元素,其阳离子和阴离子电子层结构相同,且 1 mol XY2 含有 54 mol 电子。
(1)该融雪剂的化学式是___________,该物质中化学键类型是___________。
(2)元素 D、E 原子的最外层电子数是其电子层数的 2 倍,D 与 Y 相邻,则 D 的 离子结构示意图是___________;D 与 E 能形成一种结构类似于 CO2 的三原子 分子,且每个原子均达到了 8e-稳定结构,该分子的电子式为___________, 化学键类型为___________ (填“离子键”或“共价键”)。
(3)W 是与 D 同主族的短周期元素,Z 是第三周期金属性最强的元素,Z 的单质 在 W 的常见单质中反应时有两种产物:不加热时生成___________,其化学键类型为___________;加热时生成___________,其化学键类型为___________,电子式为___________。
【答案】CaCl2 离子键 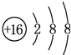
![]() 共价键 Na2O 离子键 Na2O2 离子键和非极性共价键
共价键 Na2O 离子键 Na2O2 离子键和非极性共价键 ![]()
【解析】
X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为![]() =18,为Ca2+、Cl-;元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素;W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,据此分析解答。
=18,为Ca2+、Cl-;元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素;W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,据此分析解答。
(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为![]() =18,则为Ca2+、Cl-,故XY2是CaCl2,属于离子化合物,含有离子键,故答案为:CaCl2;离子键;
=18,则为Ca2+、Cl-,故XY2是CaCl2,属于离子化合物,含有离子键,故答案为:CaCl2;离子键;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,S2-离子结构示意图是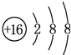 ;则E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,其电子式为
;则E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的类似于CO2的三原子分子为CS2,与二氧化碳结构类似,其电子式为![]() ,为共价化合物,含有极性共价键,故答案为:
,为共价化合物,含有极性共价键,故答案为: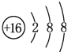 ;
;![]() ;共价键;
;共价键;
(3)W是与S同主族的短周期元素,则W为O元素,Z是第三周期金属性最强的元素,则Z为Na,钠与氧气反应,不加热生成Na2O,属于离子化合物,含有离子键,加热生成Na2O2,属于离子化合物,含有离子键和非极性共价键,电子式为![]() ,故答案为:Na2O;离子键;Na2O2;离子键和非极性共价键;
,故答案为:Na2O;离子键;Na2O2;离子键和非极性共价键;![]() 。
。


科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )
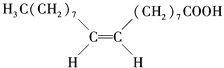
A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如 所示,1183 K以上转变为
所示,1183 K以上转变为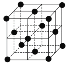 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g。A能与NaHCO3溶液发生反应,且2分子A之间脱水可生成六元环化合物。有关A的说法正确的是( )
A.分子式是C3H8O3
B.A催化氧化的产物能发生银镜反应
C.0.1 molA与足量Na反应产生2.24LH2(标准状况)
D.A在一定条件下发生缩聚反应的产物是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用系统命名法命名有机物![]() 和
和 主链碳原子数均为7个
主链碳原子数均为7个
B.某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
C.碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种
D.苯甲醛分子中所有的原子不一定共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
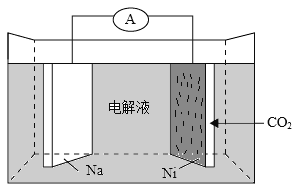
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是( )
2Z(g),此反应达到平衡的标志是( )
A. 容器内密度不随时间变化B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2D. 单位时间消耗0.1mol X同时生成0.2mol Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com