
【题目】下图是H2(g)+Cl2(g)=2HCl(g)反应过程中的能量变化图。
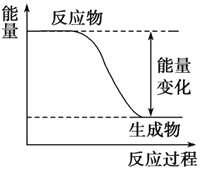
(1)由图可知,1 mol H2(g)和1 mol Cl2(g)的总能量____(填“>”、“<”或者“=”) 2 mol HCl(g)的能量。
(2)该反应是___________(填“吸”或者 “放”)热反应,从化学键的角度进行解释__________________________。
科目:高中化学 来源: 题型:
【题目】2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
(1)该氮氢化合物的电子式为 .
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 .
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗。
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种有机物的相互转化图如下:

请回答:
(1)Y的结构简式是______________。
(2)反应①的反应类型是______________。
(3)X→Y的方程式是______________。
(4)X+Z→W的方程式是______________,实验室常用下图所示的装置实现这一转化。

① 试管b中一般加入_________________________溶液。
② 从试管b中分离出W的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如右下图所示反应关系吸图中“—”相连的两种物质能发生反应)。下列判断一定正确的是
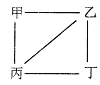
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在天平的两个托盘上,分别放上质量相等的两个烧杯,在烧杯中分别加入50ml 0.1mol / L的硫酸,此时天平处于平衡状态,然后分别向两只烧杯中加入等质量且过量的NaHCO3和Na2CO3粉末。待两烧杯完全反应后,则天平两边( )
A.放Na2CO3的一端托盘下沉 B.仍保持平衡
C.放NaHCO3的端托盘下沉 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钴(CoCl2)可溶于水,常用作湿度和水分的指示剂,工业上也可用于制取钴。
(1)钴元素的常见化合价与铁元素相同。往CoCl2溶液中加入NaOH溶液产生粉红色沉淀,露置于空气中一段时间后,沉淀变为棕褐色。
① 化合态钴的常见化合价有_______。
② 沉淀由粉红色变为棕褐色反应的化学方程式为_______________。
(2)将CoCl2溶于浓盐酸中能形成[CoCl4]2-,溶液中存在平衡:[Co(H2O)6]2++4Cl-![]() [CoCl2]2-+6H2O
[CoCl2]2-+6H2O
T1℃时,将0.025mol CoCl2·6H2O溶于50mL 12mol/L浓盐酸中,再加水稀释至100 mL。溶液中c(Cl-)与温度(T)的关系如右图所示。
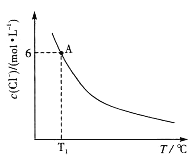
① Tl ℃时,取10mL上述溶液稀释至l00mL,稀释后的溶液中c(Cl-)______0.6mol·L-1(填“>”“=”或“<”)。
② 由图可知,上述反应的△H______0(填“>”“=”或“<”)。
③ 根据A点数据,计算出T1℃时上述反应的平衡常数为________。
(3)采用下图所示装置(Ti-Ru电极为惰性电极)电解CoCl2溶液制取钴。Co能与强酸反应产生H2,不利于Co的沉积,故电解过程中,CoCl2溶液的pH通常控制在3.9~4.2。

① Co沉积在_______(填“Ti-Ru”或“Ti”) 电极上。
② CoCl2溶液中常含有少量Cu2+、Fe3+、Na+等,为提高产品的纯度和电流效率,电解前必须将其中的_______(填离子符号)除去。
③ 若用CoSO4溶液代替CoCl2溶液,会使产率降低。其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知:CO2(g)+3H2(g) == CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
2H2(g)+O2(g) == 2H2O(l) ΔH=-bkJ·mol-1;
CH3OH(g) == CH3OH(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:________________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
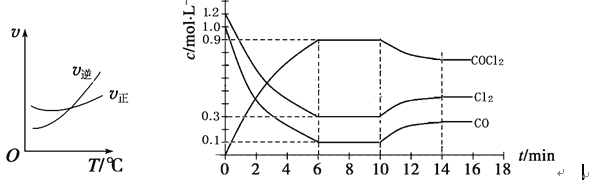
①0~6 min内,反应的平均速率v(Cl2)=__________;
②10min改变的条件是________.
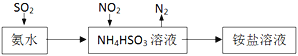
(3)利用氨水可以将SO2和NO2吸收,原理如下左图所示:,NO2被吸收的离子方程式是____________________。
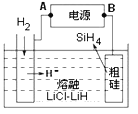
(4)用粗硅作原料,熔融盐电解法制取硅烷原理如上右图,判断B为电源的______极,电解时阳极的电极反应式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com