
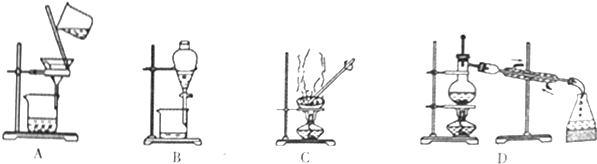
分析 (1)水与酒精互溶,但沸点不同;
(2)水与煤油分层;
(3)NaCl溶于水,为可溶性固体与液体分离;
(4)沙子不溶于水,而氯化钠溶于水.
解答 解:(1)水与酒精互溶,但沸点不同,则选择蒸馏法分离,为D装置,故答案为:D;
(2)水与煤油分层,选择分液法分离,为B装置,故答案为:B;
(3)NaCl溶于水,为可溶性固体与液体分离,选择蒸发分离,为C装置,故答案为:C;
(4)沙子不溶于水,而氯化钠溶于水,选择过滤法分离,为A装置,故答案为:A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离提纯方法及装置为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
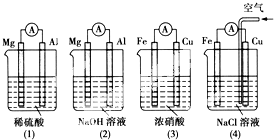
| A. | (1)(2)中活泼的Mg均作负极 | |
| B. | (2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ | |
| C. | (3)中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | (4)中Cu作正极,电极反应式为2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
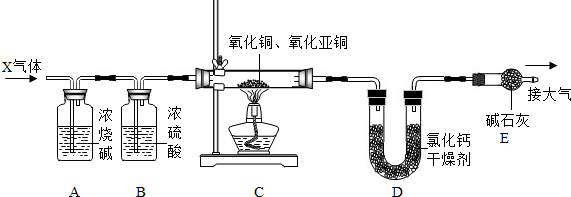
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
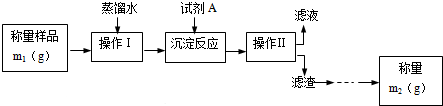
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为看到明显的实验现象,实验药品的取用越多越好 | |
| B. | 成功的化学实验必须严格遵守操作规程并取得预期成果,未取得预期成果的实验都是失败的 | |
| C. | 即使借助精密的仪器,采用规范的操作,化学实验依然会存在误差 | |
| D. | 为节约时间,保证实验顺利进行,应在所有的实验步骤都完成后再进行现象和数据的记录 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H20分子中只含有非极性共价键 | |
| B. | H20分子中只含有极性共价键 | |
| C. | 水分子间只存在氢键 | |
| D. | 冷却反应堆用水在地球上常温下是固态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com