
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.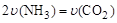 B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
④氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率___________________________。
⑥根据图中信息,如何说明水解反应速率随温度升高而增大:_______________________。
(1)①BC ②1.6×10-8(mol·L-1)3 ③增加; ④>,>(2)⑤0.05mol·L-1·min-1;
⑥25℃反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大。
【解析】(1)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中不能表示正逆反应速率相等;根据反应的方程式可知,反应是体积增大的,因此压强也是增大,B不能说明;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,所以C可以说明;反应物是固体,氨气和CO2的体积之比始终是2︰1的,所以NH3的体积分数始终为2/3,D不能说明,答案选BC。
②根据方程式可知,氨气和CO2的体积之比始终是2︰1的,所以氨气和CO2的浓度也是2︰1的,所以氨气和CO2的浓度分别是3.2×10-3mol/L和1.6×10-3mol/L,因此平衡常数K=c2(NH3)·c(CO2)=1.6×10-8(mol·L-1)3。
③增大压强,平衡向逆反应方向移动,氨基甲酸铵固体的质量增加。
④据表中数据,升高温度,压强增大,平衡向正反应方向移动,则正反应是吸热反应。即△H>0;固体分解为气体,所以△S>0。
(2)⑤根据图像可知,0~6min氨基甲酸铵水解反应的平均速率
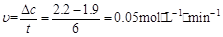 。
。
⑥根据图像可知,25℃反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,这说明水解反应速率随温度升高而增大。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化学 来源:2012届江西省南昌三中高三第三次月考化学试卷(带解析) 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)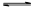 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 B.密闭容器中总压强不变
B.密闭容器中总压强不变 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
查看答案和解析>>
科目:高中化学 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(12分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)  ?2NH3(g)+CO2(g)
?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压 强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体 总浓度/ mol·L-1 |
2.4× 10-3 |
3.4× 10-3 |
4.8× 10-3 |
6.8× 10-3 |
9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是( )
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)该分解反应的平衡常数表达式为____________________________,根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________________。(保留两位有效数字)
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”“减少”或“不变”);
(4)氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS________0 (填“>”“=”或“<”)。此反应在该温度下能自发进行原因是 ________ 效应大于 ___________效应.
查看答案和解析>>
科目:高中化学 来源:2014届吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:实验题
(10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com