
分析 (1)根据N=nNA计算出1mol水中含有的水分子数目;
(2)根据m=nM计算出1mol水的质量;
(3)根据n=$\frac{m}{M}$可知1mol为18g水的物质的量;
(4)水的相对分子质量为18,根据相对分子质量与摩尔质量的关系解答.
解答 解:(1)1molH2O中含有水分子的数目为NA,
故答案为:NA;
(2)1molH2O的质量为:18g/mol×1mol=18g,
故答案为:18g;
(3)18g水的物质的量为:$\frac{18g}{18g/mol}$=1mol,所以1mol为18g水的物质的量,
故答案为:物质的量;
(4)H2O的相对分子质量为18,其摩尔质量为18g/mol,
故答案为:18g/mol.
点评 本题考查的物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuO作还原剂 | B. | 铜元素化合价降低 | ||
| C. | CuO作氧化剂 | D. | 铜元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
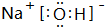 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

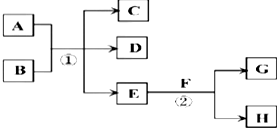
| A. | ①中,d极发生氧化反应、c极发生还原反应 | |
| B. | ②中从a口通入气体,可用于收集H2、NH3、CH4等气体 | |
| C. | ③中X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 | |
| D. | ④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a+b<c+d,则反应一定能自发向右进行 | |
| B. | 若起始时A、B的物质的量之比为a:b,则平衡时的转化率之比为1:1 | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n molB,则平衡时气体的总物质的量小于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
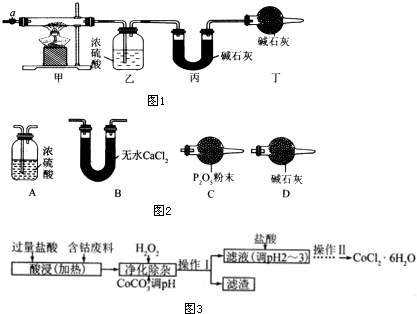
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com